江苏省新沂市人民医院普通肿瘤外(II)科 江苏新沂 221400
【摘 要】目的 探讨COX-2、MMP-9在乳腺癌及癌旁组织中的表达及其与微血管密度(MVD)的关系。方法 应用免疫组化ENVISION法检测60例乳腺癌及20例癌旁组织中COX-2、MMP-9蛋白的表达情况,用CD34抗体标记乳腺癌血管内皮细胞,计算MVD。 结果 COX-2、MMP-9在乳腺癌中阳性表达分别为68.3 %、63.3 % , 显著高于癌旁组织,差异有统计学意义(P < 0.01) ,两者表达呈正相关(r = 0 .461 , P < 0.001)。 COX-2、MMP-9阳性的乳腺癌组织MVD 高于阴性者,差异有统计学意义(P < 0. 01) , COX-2、MMP-9 均阳性时MVD 最大(P < 0.01), COX-2、MMP-9、MVD 与肿瘤临床分期、淋巴结转移密切相关(P < 0.01)。结论 乳腺癌组织中COX-2、MMP-9呈过表达,两者在其发生、发展过程中具有协同作用,对肿瘤新生血管生成可能有重要作用。
【关键词】 乳腺癌; 环氧合酶-2;基质金属蛋白酶-9; 微血管密度(MVD)
[Abstract] Objective To study the expression of COX-2 and MMP-9 in invasive ductal carcinoma and normal tissues adjacent to tumor of breast and the relationship with microvascular density (MVD). Methods COX-2 and MMP-9 protein expression were detected by immunohistochemical methods in 60 cases of breast carcinoma and 20 patients with normal breast tissues adjacent to tumor. CD34 marking vascular endothelialcell was used to measure the microvascular density (MVD) . Results The positive expression rates of COX-2 and MMP-9 in breast carcinoma was 68. 3 % and 63. 3 % , showing a significant difference between breast carcinoma and normal breast tissues adjacent to tumor (P<0.01), Expression of COX-2 was positively correlated with expression of MMP-9 ( r = 0. 461 , P < 0. 001) . MVD in MMP-9 ( + ) or COX-2 ( + ) group was significantly higher than that in COX-2 ( - ) or MMP-9 ( - ) group ( P < 0. 01) . The MVD reached the maximumin patients whose COX-2 and MMP-9 were both positive ( P < 0. 01) . The expression of COX-2 , MMP-9 and MVD were significantly correlated with lymphatic metastasis and surgical pathologic staging ( P <0. 01) . Conclusions There have overexpresion of COX-2 and MMP-9 in breast carcinoma ,they have asynergistic effect in the development of breast carcinoma and may play an important role in angiogenesis of breast carcinoma.
[Key words] Breast carcinoma ; Cyclooxygenase-2(COX-2); Matrix metalloproteinase-9(MMP-9) ; Microvascular density (MVD)
乳腺癌是典型的血管依赖性病变,它的侵袭、转移是多因素参与的复杂过程,研究表明,环氧合酶-2(Cyclooxygenase-2,COX-2)在多种肿瘤组织中高表达,与肿瘤的发生、发展、侵袭和转移密切相关。在众多溶解细胞外基质的蛋白水解酶中,基质金属蛋白酶(matrix metalloproteinases,MMPs)对肿瘤的侵袭与转移起着极为重要的作用。本研究探讨环氧合酶-2、基质金属蛋白酶-9(matrix metalloproteinase,MMP-9)在乳腺癌组织、癌旁组织中的表达,探讨其与临床病理因素及微血管生成的关系。
1 资料与方法
1.1 一般资料 选取本院2009年6月-2010年6月经病理证实为乳腺浸润性导管癌的标本60例,术前未经抗肿瘤治疗(放疗、化疗、内分泌、生物靶向治疗)。患者年龄32岁-71岁,中位年龄5O岁;绝经前33例,绝经后27例;肿瘤最大径1.5cm-11.Ocm,平均为3.5cm。腋窝淋巴结转移阳性者28例,阴性者32例。乳腺癌分期参照2002年AJCC第6版乳腺癌的TNM分期标准。I期7例,Ⅱ期29例,Ⅲ期24例,IV期0例。同期20例癌旁组织(距肿瘤边缘5cm)作对照。
1.2 试剂与方法 COX-2兔抗人单克隆抗体、MMP-9鼠抗人单克隆抗体、免疫组化试剂盒及DAB底物显色剂均购自北京中杉金桥生物技术有限公司。组织经10%福尔马林固定、常规石蜡包埋,4μm 厚切片,分别进行HE 染色和免疫组化染色, 一抗COX-2兔抗人单克隆抗体、MMP-9鼠抗人单克隆抗体均为工作液,CD34 抗体为即用型。用EnVision两步法。
1.3 染色结果判断 染色后,10×40高倍视野下,随机选l0个视野,每个视野选100个肿瘤细胞,共计1000个肿瘤细胞。COX-2、MMP-9染色结果判定以胞质内出现棕黄色颗粒为阳性细胞,按肿瘤细胞中阳性比例计算百分率,阳性细胞<10%记为阴性“-”,≥10%记为阳性“+~+++”(10%~25%记为“+”,25%~50%记为“++”,>50%记为“+++”)。MVD 测定方法:每张切片在100倍光镜下挑选血管分布最高区域,在200倍光镜下记数5个视野内被CD34染成棕色的血管数,取其平均值为该例肿瘤的MVD 值,结果以x±s 表示。与临近微血管明显分开的阳性染色的血管内皮细胞或细胞簇均视为独立的微血管,管径大于8 个红细胞的血管不计数。
1.4 统计学方法 用SPSS13.0 软件进行统计学分析,用χ2 检验、Spearman 秩相关检验、方差分析分析相关数据。
2 结果
2.1 COX-2和MMP-9 在乳腺组织中的表达:6O例乳腺癌组织中COX-2、MMP-9阳性者分别为41例(68.3%)、38例(63.3%),癌旁组织阳性者表达分别为4例 (20%)、3例(15%),两者比较差异有统计学意义 (P<O.05)。见表1

2.2 COX-2和MMP-9表达与临床病理因素的关系: COX-2阳性表达与患者年龄、肿块大小无明显相关性(P>0.05),而与淋巴结转移、TNM分期、组织学分级显著相关(P<0.05);MMP-9阳性表达与患者的年龄、肿块大小、组织学分级无明显相关性(P>0.05);而与淋巴结转移、TNM分期显著相关(P<0.05)。见表2。
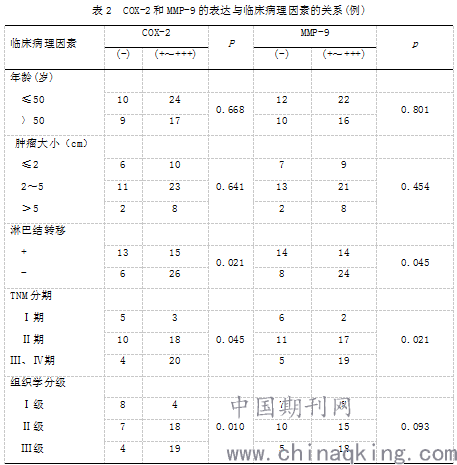
2.3 COX-2、MMP-9 表达的相关性:在6O例乳腺癌组织中,COX-2、MMP-9同时表达阳性的有30例(50%),同时表达阴性的有l1例(18%),COX-2表达阳性、MMP-9表达阴性的有11例 (18%),COX-2表达阴性、MMP-9表达阳性的有8例(13%),经等级相关检验,乳腺癌组织中COX-2和MMP-9表达呈显著正相关r=0.630,P<0.O1)。

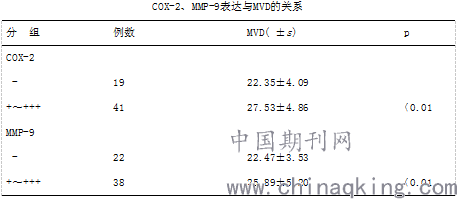
2.4 COX-2、MMP-9 表达与MVD 的关系:COX-2 41例表达阳性乳腺癌组织的MVD为27.53±4.86,明显高于l9例表达阴性者22.35±4.09,P<0.O1;MMP-9 38例表达阳性乳腺癌组织的MVD为25.89±5.20,明显高于22例表达阴性者22.47±3.53, P<0.01。COX-2、MMP-9表达阳性的乳腺癌中其MVD 均明显高于其相应表达阴性者, P < 0.01 ,见表4 。
3讨论
环氧合酶(Cyclooxygenase,COX)是催化花生四烯酸转化为前列腺素的重要限速酶,它有2种同工酶:COX-1和COX-2。COX-1在大多数组织中均有表达,参与机体正常的生理功能,如保护胃黏膜,控制血小板聚集等;COX-2静息时并不表达,但在细胞因子、生长因子、癌基因等刺激因子的作用下可被诱导表达。近年来多方面证据表明,COX-2与肿瘤的发生发展有关。Shim等[1]报道46例导管原位癌COX-2阳性率是85%,其表达水平与核分级有关,而且癌旁组织染色强度要高于癌灶,Ristimaki等[2]用免疫组化法检测了1576例浸润性乳腺癌标本中COX-2的表达,发现37.4%高表达,COX-2的表达水平与TNM分期、组织学分级、ER阴性表达、腋窝淋巴结转移、HER-2过表达呈正相关。Sivula等[3]研究发现浸润性乳腺癌组织中COX-2的阳性表达率为66%,COX-2阳性者预后不佳。本研究发现乳腺癌组织中COX-2的阳性表达与淋巴结转移情况、TNM分期有关,与文献报道一致,提示COX-2可以作为预测乳腺癌侵袭、转移一个重要生物标志。
MMPs是一组具有高度同源性的结构和功能相关的锌离子依赖性内肽酶,通常由纤维母细胞、中性白细胞、巨噬细胞及肿瘤细胞产生。目前至少已发现了28种。一般认为与肿瘤侵袭、转移关系最密切的是MMP-9和MMP-2。MMP-9属于明胶酶也称Ⅳ型胶原酶,是MMPs家族中分子量(92 kD)最大的酶,它以酶原的形式分泌,被激活后形成Ⅳ型胶原酶,降解、破坏靠近肿瘤表面的细胞外基质中的Ⅳ型、Ⅴ型胶原、层粘连蛋白和明胶,最终导致肿瘤的侵袭、转移。在正常稳态组织中MMP-9表达量很少,参与人体的多种生理及病理过程,在肿瘤发生发展过程中, MMPs常过度表达。近年来研究表明MMP-9与乳腺癌的侵袭性、转移以及骨破坏有关[4];Wolf 等[5]报道了在乳腺癌中MMP-9mRNA的表达与腋窝淋巴结的转移成正相关;Hanemaaijer 等[6]发现在乳腺癌组织中MMP-9活性较纤维腺瘤明显升高, MMP-9 高表达的乳腺癌侵袭性和转移性较高,并与肿瘤细胞的分化程度和组织学分级、TNM分期相关。本研究发现与癌旁组织相比,乳腺癌组织中MMP-9的阳性率显著高,MMP-9阳性表达者组织分化不好、TNM分期较晚,并且易出现淋巴结转移。推测MMP-9 参与了乳腺癌的发生、发展,可能是一个早期指标,与肿瘤的高侵袭不良预后有关。
研究表明COX-2可以引起MMPs的表达增加,Tsujii等[7]曾研究发现,在COX-2高表达的肿瘤细胞可伴有MMPs表达的显著增高,并发现其转移侵袭活性较不伴有MMPs表达者增强。Masunaga等[8]研究发现COX-2可上调基质金属蛋白酶的表达,降解细胞外基质,并上调肿瘤相关血管因子的表达,促进肿瘤血管形成而增加其侵袭及转移活性,不利于预后。Ishiaki等[9]报道转染colon26(结肠癌细胞)的CDF1鼠,口服COX-2抑制剂(celecoxib)两周后处死进行研究。发现口服抑制剂组COX-2mRNA及MMP-9mRNA明显低于对照组,并且COX-2和MMP-9存在明显的相关性。本研究发现乳腺癌组织中COX-2蛋白高表达,MMP-9也高表达,而且两者具有显著正相关性(r=0.448,P<0.01)。推测可能机制:①过度表达的COX-2,促进了PGE2的合成,从而刺激MMP-9的分泌;②可能直接诱导MMP-9表达上调,增强对细胞外基质、基底膜的降解及肿瘤血管的形成,促进乳腺癌的侵袭转移。
大量研究表明新生血管生成是肿瘤生长、侵袭和转移的先决条件,新生血管不健全的基底膜和内皮细胞使肿瘤细胞更容易进入血管而发生血行转移,肿瘤内新生血管数量越多,转移的潜能就越大,MVD可准确反映新生血管生成。Yan等[10] 发现MMP-9高表达部位正是MVD高表达的部位,比较MMP-9阳性与阴性表达者的MVD发现,前者明显大于后者,有显著性差异。将MMPs抑制剂皮下注射于实验鼠血管瘤和肿瘤周围,可抑制肿瘤生长。本研究结果显示: 在COX-2、MMP-9 阳性表达标本中MVD 显著高于阴性表达组,提示COX-2、MMP-9高表达与乳腺癌的血管生成有关, COX-2、MMP-9 均阳性组MVD 最高,提示两者可能具有协同作用。与以上研究基本相似。目前认为,VEGF 是COX-2、MMP-9重要的靶向基因, VEGF 表达增加,从而诱导新生血管生成。提示COX-2、MMP-9可能共同促进肿瘤间质新生血管生成来加速肿瘤的生长、侵袭与转移。COX-2、MMP-9 共同表达,协同刺激血管生成,其确切机制有待进一步研究。
恶性肿瘤的转移是肿瘤患者治疗失败和死亡的主要原因。目前以选择性COX-2、MMPs抑制剂,以及以肿瘤新生血管作为靶点的已成为重要的抗癌措施,特别是对MVD值大的乳腺癌患者。随着人们对乳腺癌侵袭、转移机制的深人了解和对COX-2、MMPs抑制剂的充分研究,针对COX-2、MMPs的靶向治疗同时联合抗血管生成治疗,可能为乳腺癌的综合治疗提供了新的途径。
【参考文献】
[1] Shim V,Gauthier ML,Sudilovsky D,et a1.Cyclooxygenase-2 expression is related to nuclear grade in ductal carcinoma in situ and is increased in its normal adjacent epithelium [J]. Cancer Res,2003,63(10):2347.
[2] Ristimaki A,Sivula A,Lundin J,et a1.Prognostic significance of elevated cyclooxygenase-2 expression in breast cancer[J]. Cancer Res,2002,62(3):632.
[3]Sivula A,Talvensaari-Mattila A,Lundin J,et a1.Association of cyclooxygenase-2 and matrix metalloproteinase-2 expression in human breast cancer[J]. Breast Cancer Res Treat,2005,89(3):215.
[4] Yu Q , Stamenkovic I. Cell surface - localized matrix metalloproteinase-9 proteolytically activates TGF-beta and promotes tumor invasion and angiogenesis [ J ] . Genes ,2006 , 14 (2) : 163 -76.
[5] Wolf C , Rouyer N , Lutz Y, et al. Stromelysin 3 belongs to asubgroup of proteinases expressed in breast carcinoma fibroblasticcells and possibly implicated in tumor progression [ J ] . Proc NatlAcade Sci USA , 1993 , 90(3) :1843.
[6] Hanemaaijer R , Verheijen J H , Magcire TM , et al . Increased gelatinase and gelatinase Bactivities in malignant vs. benignbreast tumors [ J ] .IntCancer ,2000 ,86 (2) :2042207.
[7] Tsujii M,DuBois RN.Alterations in cellular adhesion and optosis in epithelial cells overexpressing prostaglan din endoperoxide synthase [J]. Cell,1995,83(3):493.
[8] Masunaga R,Kohno H,Dhar DK,et a1.Cyclooxygenase-2 expression corelates with tumor neovascularization and prognosis in human colorectal carcinoma patients [J]. Clin Cancer Res,2000,6(10):4064.
[9] Ishiaki T,Katsumata K,Tsachida A, et al. Etodolac,a selective cyclooxygenase-2 inhibitor,inhibits liver metastasis of colorectal cancer cell via the suppression of MMP-9 activity [J]. Int J Mol Med,2006,17(2):357-362.
[10] Yan zhi xin,Guo zhong xing. Expression of MMP-9 and Intratumor Microvessel Density in breast carcinoma:Correlation with Biological Characteristics [J]. The Pratical Journal of Cancer, 2002,17(4):359-362.
论文作者:王祥军 吴新勇 何长青
论文发表刊物:《临床医学教育》2018年1期
论文发表时间:2018/3/20
标签:乳腺癌论文; 肿瘤论文; 阳性论文; 组织论文; 血管论文; 阴性论文; 细胞论文; 《临床医学教育》2018年1期论文;
