南京中医药大学基础医学院 江苏南京 210046
摘 要 目的:探讨没食子酸(gallic acid,GA)体外对胃癌细胞株MGC-803的抑制作用。方法:体外培养人胃癌细胞株MGC-803,MTT法观察细胞生长情况; Hoechst-33258、AnnexinV-FITC/PI检测细胞凋亡情况;RT-PCR方法研究Survivin的mRNA的变化,评价GA对胃癌细胞MGC-803的抑制作用及机制。结果:MTT检测6.25~50umol/LGA可抑制MGC-803的生长,并呈剂量依赖性。Hoechest-33258显示出明显的细胞凋亡形态。用Annexin V-FITC/PI检测细胞凋亡率有显著的剂量依赖性。同时RT-PCR反映了GA作用后,胃癌细胞中Survivin mRNA表达减少。结论:GA可抑制胃癌细胞MGC-803的增殖,这可能与下调相关凋亡基因Survivin有关。
关键词:没食子酸; MGC-803;细胞凋亡;Survivin
Abstract:Objective To investigate the potential mechanism of inhibition of gallic acid (GA) on growth of human gastric cancer cell lines MGC-803 in vitro.Methods :MGC-803 cells were cultured in vitro.MTT assay was used to observe the on growth of MGC-803 cells. Apoptosis of the cells was analyzed by Hoechest-33258 staining. Annexin V-FITC/PI staining was used to quantify the percentages of apoptosis in the total cell population.The expressions of survivin in mRNA was investigated by RT-PCR. Results:GA can inhibit the growth of human gastric cancer cells and induce cell apoptosis. Its mechanism may be associated with blocking surviving expression.
Keywords:Gallic acid; MGC-803; Cell apoptosis; Survivin
0引言
没食子酸(Gallic acid,GA)是一种有机酸,化学名是3,4,5一三羟基苯甲酸。广泛分布于山茱萸[1,2]、藏药红景天[3]、芍药[4]、泽漆[5]等多种天然中草药中。GA可以抑制多种肿瘤细胞增殖并诱导其凋亡,但其作用机制尚不十分清楚。本研究旨在观察GA体外对人胃癌细胞株MGC-803的影响,进一步探讨GA的抗肿瘤作用机制。
1 材料与方法
1.1药品和试剂
GA(99﹪,分子量188.14,中国药品生物制品检定所),用无血清的RPMI-1640(美国Gibco公司)培养液配置成浓度为1mm/L的储存液,0.22um的滤器过滤除菌,避光-20℃保存;MTT(美国Sigma公司)溶于PBS中,浓度为5mg/mL,过滤除菌后4℃避光保存。小牛血清(杭州四季青公司),Hoechst-33258、Annexin V-FITC/PI检测试剂盒均购自南京凯基生物公司,RT-PCR试剂盒购自美国Sigma公司。
1.2细胞系
MGC-803(南京凯基生物公司),体外用RPMI-1640培养液(内含有10﹪小牛血清,100U/ml的青霉素和链霉素),置5﹪CO2、95﹪空气的CO2孵箱中,在37℃、95﹪湿度条件下培养,取指数生长期细胞用于实验。
1.3. MTT检测:
将MGC-803细胞制成1×105/mL的细胞悬液,以每孔180μL接种于96孔培养板。待细胞贴壁后,加入GA使其终浓度分别为0、3.125、6.25、12.5、25、50 μM,每个药物浓度组各设6个平行孔。于GA作用48 h时分别加入MTT,4h后离心弃上清液,每孔均加入DMSO150μL,混匀后置于酶标仪于490nm波长处测吸光度(OD)值。计算生长抑制率IR(%):[抑制率IR(% )=(1-OD处理组/OD对照组)×100%],并采用Bliss法计算半数抑制浓度(IC50),为以下实验GA剂量选择提供依据。实验重复3次。
1.4 Hoechst-33258染色法:
用0、6.25、25Μm GA分别处理MGC-803细胞48h,胰酶消化后,1000r/min离心6min,收集细胞,加入固定液[甲醇-冰醋酸(3∶1)]4℃固定15min,离心弃固定液,加入Hoechst-33258染液37℃避光染色20min。离心弃染液,PBS洗涤2次后,滴片,紫外光激发下荧光显微镜(Olympus,BX-60,Japan)观察凋亡并拍照。实验重复3次。
1.5 Annexin V-FITC/PI检测法:
将MGC-803细胞制成1×105/mL的细胞悬液,以每孔1800μL接种于6孔培养板。待细胞贴壁后,加入GA使其终浓度分别为0、6.25、25μmol/L,于GA作用48h,收集细胞,按照Annexin V-FITC/PI试剂盒使用说明,加入500μLbinding buffer和5μLAnnexin V-FITC,5μLPI,避光染色15 min,流式细胞仪进行检测和数据分析。实验重复3次。
1.6 RT-PCR法;
将0、6.25、12.5、25μM GA处理48h后的MGC-803细胞用TRIZOL Reagent提取总RNA,紫外分光光度计准确定量纯度及含量,相同条件下进行反转录。survivin上游引物P1:5′-GCA TGG GTG CCC CGA CGT TG-3′;下游引物P2:5′-GCT CCG GCC AGA GGC CTC AA-3′同时以GAPDH为内参照,GAPDH的引物序列为P1:5′- GCC TCA AGA TCA TCA GCA A-3′;下游引物P2:5′- CCA GCG TCA AAG GTG GAG-3′。PCR条件以94℃变性2min后,按下述参数循环30次:94℃变性30s,62℃退火1min,72℃延伸1min。
2 结果
2. 1 GA对MGC-803细胞的抑制作用:
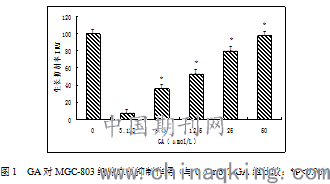
不同剂量GA (3.125、6.25、12.5、25、50μmol/L) 分别作用于MGC-803细胞后的抑制率为7.5±2.24%、35.7±3.40%、52.5±1.09%、79.5±1.13%、97.7±2.02%与对照组(0μmol/LGA组) 相比,6.25~50μmol/L GA呈剂量依赖性地抑制MGC-803生长,而3.125μmol/LGA无明显抑制作用,见图1。半数抑制率IC50为11.92±1.02μmol/L,以上结果显示:不同浓度GA作用于MGC803细胞48h后,细胞生长有不同程度的抑制作用,且有明显的浓度依赖性。
2. 2 荧光染色结果:
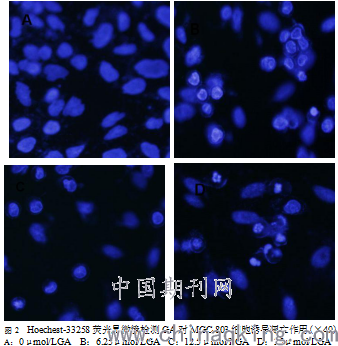
荧光显微镜观察发现不同浓度GA作用48h后,形态呈剂量增加而变化明显。0μmol/LGA作用组染色质分布均匀,细胞体积大小一致,呈弥散均匀蓝白色荧光;而6.25μmol/LGA作用组部分细胞染色质呈浓染的块状或颗粒状,聚集于核周边;12.5μmol/LGA作用组较多细胞胞内染色质分布不均,形成荧光斑点。而25μmol/LGA作用组出现细胞碎片及凋亡小体,呈凋亡特征性改变,效果很明显 (图2)。
2. 3 流式细胞仪分析结果;
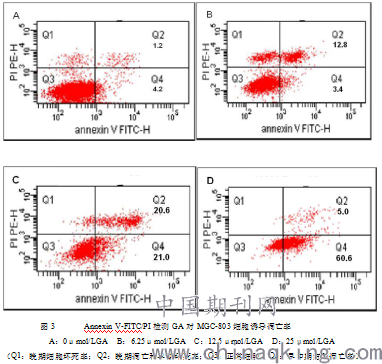
不同浓度GA作用48h后,与对照组(0μmol/L UA)相比,6.25、12.5、25μmol/LGA可使细胞凋亡率随GA浓度增加而逐渐增加(图3)。
2. 4 Rt-PCR检测结果:总RNA经反转录,相同条件下30个PCR反应循环后,1.5﹪琼脂糖凝胶电泳显示,对照细胞有明显的survivin mRNA条带,而用药组随着剂量的增加,条带逐渐减弱,25μmol/LGA组仅有非常微弱的条带,作为内参照的GAPDH4组条带亮度基本一致(图4),反映了GA能抑制胃癌细胞株MGC-803survivin的表达。

3 讨论
近年来GA抗肿瘤的作用日益受到人们的重视,研究发现GA对肝癌细胞株Bele-7404、小鼠肉瘤细胞株-S180等多种肿瘤细胞均具有较强的抗肿瘤活性[6]。本研究发现GA对胃癌细胞株MGC-803也有较强的抑制作用。MTT实验显示,其在剂量很小时(3.125μM)就对胃癌细胞有明显的抑制作用。GA作用胃癌48h后,IC50为(11.92±1.02μM),用低于IC50的GA(6.25μM)处理MGC-803细胞后,细胞生长受到抑制,Hoechst显示:细胞染色质呈浓染的块状或颗粒状,聚集于核周边;用剂量高于IC50的GA(25μM),MGC-803细胞除出现明显提高凋亡率外,还出现肿胀以及凋亡小体等坏死表现。提示:GA可以通过细胞毒、增殖抑制、诱导凋亡等作用,抑制胃癌MGC-803细胞的生长,并呈剂量依赖性。
自1972年Kerr等[7]首先提出细胞调亡是细胞的一种主动自杀过程以来,越来越多研究证明细胞凋亡是有相关基因进行调控的细胞自主死亡的过程,凋亡相关基因包括凋亡抑制基因,如bcl-2,P53,survivin等,通过相应蛋白产物发挥调控凋亡的作用,Chenghua-lou等[8]研究证明survivin基因在抗胃癌中发挥下调作用。本实验研究证实随GA浓度的增加survivinmRNA表达逐渐减弱,细胞凋亡率逐渐提高。由此推测:GA对凋亡相关基因的影响,可能通过下调凋亡抑制基因survivin的表达,从而促进MGC-803细胞的凋亡。
综上所述,本实验研究证实GA对胃癌细胞MGC-803有明显的生长抑制作用,其具体机制可能与细胞毒作用,抑制细胞增殖,以及下调凋亡抑制基因survivin的表达有关。
参考文献
[1] 张广强,刘伟,尚遂存,等. 山茱萸核中脂肪酸的测定[J]. 中药材,1991, 1(1):38.
[2] Mitsuo Miyazawa,Hiromu Kameoka. Volatile Flavor Components of CORNI FRUCTUS (cornus officinalis Sieb.et Zucc.)[J]. Agric. Biol. Chem. 1989,53(12):3337.
[3] Li J S,Wang J X,Zhang J X,et al,Studies on the chemical constituents of Rhodiola dumulosa(Franch.)Fu [J].J Xi an Med Univ(西安医科大学学报),1997,18(3):369-371.
[4]李玉东,刁勇,王立强,芍药及其有效成分抗肿瘤作用的研究进展[J].海峡药学,2009,21(12):27-32.
[5]RuanHL(阮汉利), ZhangYH(张勇慧), PiHF(皮慧芳),et al.Chemical constituents of Balanophora japonica Makino.Nat Prod Res Dev(天然产物研究与开发), 2006, 18: 74-75.
[6] 钟振国,梁红,钟益宁,等,余甘子叶提取成分没食子酸的体外抗肿瘤实验研究,时珍国医国药2009,20(8):1954-1955
[7] Kerr JER, Wyllie AH, Currie AH, et al. Apoptosis, a basicbiological phenomenon
with wider implications in tissuehinetics. Br J Cancer, 1972, 26(4): 239-257.
[8] Chenghua Lou ,Mingyan Wang ,Guangming Yang ,et al. 2’, 4’-dihydroxychalcone isolated from Oxytropis falcate herb induced the apoptosis of human gastric cancer via down-regulation of survivin mRNA[J].Toxicology in vitro,2010,24(2010):1333-1337.
论文作者:李沐涵 王明艳 赵凤鸣
论文发表刊物:《临床医学教育》2018年5期
论文发表时间:2018/6/21
标签:细胞论文; 作用论文; 抑制论文; 胃癌论文; 凋亡论文; 浓度论文; 细胞株论文; 《临床医学教育》2018年5期论文;
