引言骨缺损是临床常见的问题。由于脱钙骨基质(demineralized bone matrices, DBMs)具有较好的骨诱导潜能,其已成为修复骨缺损的研究热点[1]。然而在临床骨缺损修复过程中,常常发现单独使用DBM的效果十分有限[2]。在更多的研究中,DBM通常与人体外源性细胞因子联合作用于骨缺损的修复[3]。然而,单个细胞因子对于骨形成并无特异性[4]。已有的研究报道了特定细胞外基质(extracellular matrix, ECM)对干细胞分化的影响作用[5]。作为骨骼的主要细胞成分,成骨细胞(osteoblasts, OBs)在骨骼发育中起着重要作用[6]。OBs可以分泌大量有机基质,如I型胶原( collagen type I, COL I),骨桥蛋白(osteopontin, OPN)和骨钙素(osteocalcin, OCN)等,这些胞外基质成分已被证实与新骨形成有着十分紧密的联系[7]。因此,我们提出本研究的假设,OB所分泌的特定ECM是否能作为一种表面修饰的手段,从而增强DBM的成骨诱导潜能。为了验证该假设,我们制备了ECM修饰后的DBM(OBDBMs),并评价了其一系列生物学特征,包括OBDBM所保留的基质蛋白,细胞相容性以及其对于大鼠骨髓间充质干细胞(rat bone mesenchymal stem cells, rBMSCs)成骨分化的影响。1材料和方法1.1 DBM的制备根据已有的研究方法[8],我们制备了来源于牛皮质骨的DBM。步骤如下:将骨条在室温下置于0.6M HCl中处理72小时,得到DBM。然后用磷酸盐缓冲溶液(PBS)洗涤DBM数次,直至pH为中性。完成洗涤后,采用冰冻切片机将所有样品切成200μm并冻干。进行后续细胞实验之前,所有样品均采用环氧乙烷进行灭菌。1.2 修饰后DBM的制备为了制备修饰后的DBM(OBDBM),本研究将OBs以4.0×104个细胞/ cm2的浓度接种于DBM的表面,采用含10%FBS的DMEM培养。为了降低基质材料的免疫原性,在培养10天后,我们采用含有20mM 氢氧化铵的0.5%Triton X-100处理5分钟(37℃),脱掉OB [9]再用PBS洗涤3次以除去试剂残留物。1.3 dsDNA检测为评价OBDBM中的细胞残留情况,本研究将DBMs(n = 5),OBs-DBMs(n = 5)和OBDBMs(n = 5)的样品剪碎,经金属蛋白酶K消化后,采用酚抽提法获得含有dsDNA的上清液。然后通过ds DNA试剂盒检测DBMs,OBs-DBMs和OBDBMs的DNA含量。1.4 细胞相容性评价为了评估DBM和OBDBM的细胞相容性,将大鼠骨髓间充质干细胞(rBMSC)接种于两种基质材料表面。分别于1天,2天,,3天采用MTT细胞增殖及细胞毒性检测试剂盒(碧云天,中国)对每组样本行细胞毒性检测。接种于孔板中的rBMSCs为对照组。1.5 SDS-PAGE为检测OBDBM是否保留了部分OB分泌的ECM,本研究采用RIPA裂解液(碧云天,中国)提取了DBM(n=3)与OBDBM(n=3)的总蛋白。所提取总蛋白均通过BCA蛋白质测定试剂盒(碧云天,中国)定量后,与5×SDS-PAGE样品上样缓冲液(碧云天,中国)混合,并在100℃下加热5分钟,以使所有蛋白质变性。随后,进行SDS-PAGE电泳。步骤如下:所有样品均采用10%SDS-PAGE预制凝胶分离。电泳结束后,用考马斯蓝染色液对凝胶进行染色。采用凝胶成像仪(伯乐,美国)对DBM与OBDBM的蛋白条带进行观察和对比。1.6 Reverse Transcription-Polymerase Chain Reaction (RT-PCR)为了评估OBDBM的骨诱导性,本研究将rBMSC(1.0×105个细胞/ cm2)分别接种于DBM和OBDBM表面,培养7天。检查rBMSCs中骨相关特异性基因的表达。本研究采用TRIzol提取各样本的总RNA,并用一步法逆转录试剂盒(百奥莱博,中国)完成逆转录及PCR反应。相关特异性引物(表1),包括骨桥蛋白(osteonectin, ON),碱性磷酸酶(alkaline phosphatase, ALP)以及甘油醛-3-磷酸脱氢酶(GAPDH)由生工生物科技合成(中国)。PCR产物通过2%琼脂糖凝胶电泳后,在凝胶成像仪(伯乐,美国)下观察目的基因条带。表1Primer sequences and product sizes used for RT-PCR. Genes 5’-3’ Primer sequences Production size (bp) ALP Forward Reverse CATCGGACCCTGCCTTAC GGAGACGCCCATACCATC 169 GAPDH Forward Reverse GCAAGTTCAACGGCACAG GCCAGTAGACTCCACGACAT 140 ON Forward Reverse GCACCACTCGCTTCTTTG TTGTTGATGTCCTGCTCCT 103 2统计分析所有数据均以平均值±S.D(标准偏差)表示,并使用SPSS 22.0进行分析。对于两组比较,应用双尾two-tailed Student t检验。对于多组比较,应用单因素方差分析。 P <0.05则差异有统计学意义。3结果3.1 脱细胞效果三组(图1)的DNA含量分别为19.70±2.40 μg/ ng(DBM),153.77±10.93 μg/ ng(OBs-DBM)和23.10±2.12μg/ ng(OBDBM)。与OBs-DBM相比,DBM和OBDBM均有较低的DNA含量(p <0.01)。结果表明,两次脱细胞处理均成功地去除了细胞。
.jpg) 图13.2 细胞相容性评估在所有的检测时间点,三组的rBMSC均表现出良好活力,随着培养时间的延长,细胞增殖明显(图2),且组间未见显著差异。这一结果表明两种材料均具有良好的细胞相容性。
图13.2 细胞相容性评估在所有的检测时间点,三组的rBMSC均表现出良好活力,随着培养时间的延长,细胞增殖明显(图2),且组间未见显著差异。这一结果表明两种材料均具有良好的细胞相容性。.jpg) 图23.3 基质蛋白的保留评估 通过SDS-PAGE检测DBM和OBDBM的总蛋白情况可以发现,在保证样品上样量相同的条件下,OBDBM比DBM呈现更多的蛋白质条带(图3)。在OBDBM中,可以在15kDa至170kDa的范围内清楚地观察到丰富的蛋白质条带。相反,在DBM中仅显示少量蛋白质条带(> 40kDa)。这一结果表明OBDBM在低细胞残留的情况下保留了丰富的ECM。
图23.3 基质蛋白的保留评估 通过SDS-PAGE检测DBM和OBDBM的总蛋白情况可以发现,在保证样品上样量相同的条件下,OBDBM比DBM呈现更多的蛋白质条带(图3)。在OBDBM中,可以在15kDa至170kDa的范围内清楚地观察到丰富的蛋白质条带。相反,在DBM中仅显示少量蛋白质条带(> 40kDa)。这一结果表明OBDBM在低细胞残留的情况下保留了丰富的ECM。.jpg) 图33.4 OBDBM的骨诱导潜力为了评估OBDBM的骨诱导能力,我们分析了接种于DBM和OBDBM表面7天后,rBMSC的ON,RUNX2和ALP的表达水平。从结果来看,与DBM组相比,OBDBM组的ALP与ON的表达水平均显著上调(图4)。
图33.4 OBDBM的骨诱导潜力为了评估OBDBM的骨诱导能力,我们分析了接种于DBM和OBDBM表面7天后,rBMSC的ON,RUNX2和ALP的表达水平。从结果来看,与DBM组相比,OBDBM组的ALP与ON的表达水平均显著上调(图4)。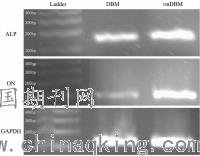 图44讨论在本研究中,我们制备了OBDBM。它具有低细胞残留,良好的细胞相容性,丰富的基质蛋白和更强的骨诱导潜力。在OBDBM的制备过程中,存在两个关键点:细胞残留和ECM的保留。低免疫原性是良好支架的重要生物学特征。这种生物学特性依赖于有效的脱细胞处理[10]。尽可能多的保留ECM可以部分模拟干细胞分化的特定微环境[11]。本研究制备的DBM表现出非常低的细胞残留,这与已有的相关研究结果一致[12]。不同的是,在本研究中,我们为了让OBs分泌的ECM与DBM共同模拟骨形成的微环境,将OBs接种在DBM的表面。在此过程中,OB显示出优异的增殖能力并分泌丰富的ECM蛋白,但同时也再次带来了免疫原性的风险,因此需要再次进行脱细胞处理。再次脱细胞处理后,H&E染色和DNA含量检测的结果证明OBDBM中的细胞几乎被完全除去。同时,SDS-PAGE结果显示OB-ECM也被很好的保留了下来。此外,细胞相容性也是本研究中OBDBM的生物学特性评价指标之一。以前的研究表明,DBM细胞毒性低,可以促进细胞增殖[13]。在本研究中,MTT实验的结果也证实了DBM和OBDBM具有相似的,良好的细胞相容性。OBs分泌的基质蛋白被认为是骨发育的重要成员。通过SDS-PAGE发现DBM和OBDBM之间总蛋白有明显的差异。 DBM仅保留了具有高分子量的蛋白质,从条带位置来看,可以判断DBM中主要是胶原蛋白,而OBDBM含有更为丰富的蛋白质条带,具有更宽的分子量范围。我们可以猜测OBDBM具有更多非胶原类蛋白,也正是这些大量的非胶原类蛋白模拟了骨发育的微环境。 BMSCs是一种多潜能的非造血骨髓细胞,通常被用作受损骨再生的种子细胞[14]。以前的研究表明,在DBMs上培养的BMSCs有成骨分化的能力[15]。值得注意的是,由于保留了大量的ECM蛋白,OBDBMs组在rBMSCs中表现出更高的ON和ALP表达水平。而这些基因是干细胞成骨的必需标志[16]。因此,我们认为OBDBM在模拟骨发育微环境及促进干细胞成骨分化方面可能具有更大的优势。综上所述,我们制备了OBDBM并证实了其具备一系列良好的生物学特性,如低细胞残留,保存完好的ECM蛋白,良好的细胞相容性和更强的骨诱导性。然而,在这项工作中尚未分析植入体内后OBDBM的性能表现。因此,后续的研究将关注OBDBM用于骨缺损的修复的效果。5结论本研究证实,OBDBM可保留较多的OB-ECM,具有低的细胞残留。与DBM相比,对于rBMSC的成骨分化促进作用更强。因此,本研究认为OB-ECM可以用作修饰支架材料的工具,OBDBM也有望作为骨重建的生物支架应用于骨组织工程研究中。参考文献[1]Hinsenkamp M, Collard JF. Growth factors in orthopaedic surgery: demineralized bone matrix versus recombinant bone morphogenetic proteins. Int Orthop. 2015;39:137-47.[2]Ramis JM, Calvo J, Matas A, Corbillo C, Gaya A, Monjo M. Enhanced osteoinductive capacity and decreased variability by enrichment of demineralized bone matrix with a bone protein extract. J Mater Sci Mater Med. 2018;29:103.[3]Johnson TB, Siderits B, Nye S, Jeong YH, Han SH, Rhyu IC, et al. Effect of guided bone regeneration on bone quality surrounding dental implants. J Biomech. 2018;pii: S0021-9290(18)30676-6.[4]Blair HC, Larrouture QC, Li Y, Lin H, Beer-Stoltz D, Liu L, et al. Osteoblast differentiation and bone matrix formation in vivo and in vitro. Tissue Eng Part B Rev. 2017;23:268-80.[5]Griffin MF, Butler PE, Seifalian AM, Kalaskar DM. Control of stem cell fate by engineering their micro and nanoenvironment. World J Stem Cells. 2015;7:37-50.[6]Souza ATP, Freitas GP, Lopes HB, Ferraz EP, Oliveira FS, Beloti MM, et al. Effect of cell therapy with allogeneic osteoblasts on bone repair of rat calvaria defects. Cytotherapy. 2018;20:1267-1277.[7]Fujisawa R, Tamura M. Acidic bone matrix proteins and their roles in calcification. Front Biosci (Landmark Ed). 2012;17:1891-903.[8]Van de Putte KA, Urist MR. Osteogenesis in the interior of intramuscular implants of decalcified bone matrix. Clin Orthop Relat Res. 1965;43:257-70.[9]He F, Chen X, Pei M. Reconstruction of an in vitro tissue-specific microenvironment to rejuvenate synovium-derived stem cells for cartilage tissue engineering. Tissue Eng Part A. 2009;15:3809.[10]You L, Weikang X, Lifeng Y, Changyan L, Yongliang L, Xiaohui W, et al. In vivo immunogenicity of bovine bone removed by a novel decellularization protocol based on supercritical carbon dioxide. Artif Cells Nanomed Biotechnol. 2018;4:1-11.[11]Wang CH, Wang TM, Young TH, Lai YK, Yen ML. The critical role of ECM proteins within the human MSC niche in endothelial differentiation. Biomaterials. 2013;34:4223-34.[12]Yang JL, Yao X, Qing Q, Zhang Y, Jiang YL, Ning LJ, et al. An engineered tendon/ligament bioscaffold derived from decellularized and demineralized cortical bone matrix. JJ Biomed Mater Res A. 2018;106:468-78.[13]Dozza B, Lesci IG, Duchi S, Della Bella E, Martini L, Salamanna F, et al. When size matters: differences in demineralized bone matrix particles affect collagen structure, mesenchymal stem cell behavior, and osteogenic potential. J Biomed Mater Res A. 2017;105:1019-33.[14]Qin Y, Wang L, Gao Z, Chen G, Zhang C. Bone marrow stromal/stem cell-derived extracellular vesicles regulate osteoblast activity and differentiation in vitro and promote bone regeneration in vivo. Sci Rep. 2016;6:21961.[15]Chen Y, Ye SH, Sato H, Zhu Y, Shanov V, Tiasha T, et al. Hybrid scaffolds of Mg alloy mesh reinforced polymer/extracellular matrix composite for critical-sized calvarial defect reconstruction. J Tissue Eng Regen Med. 2018;12:1374-88.[16]Esmailian S, Irani S, Bakhshi H, Zandi M. Biodegradable bead-on-spring nanofibers releasing beta-carotene for bone tissue engineering. Mater Sci Eng C Mater Biol Appl. 2018;92:800-6.
图44讨论在本研究中,我们制备了OBDBM。它具有低细胞残留,良好的细胞相容性,丰富的基质蛋白和更强的骨诱导潜力。在OBDBM的制备过程中,存在两个关键点:细胞残留和ECM的保留。低免疫原性是良好支架的重要生物学特征。这种生物学特性依赖于有效的脱细胞处理[10]。尽可能多的保留ECM可以部分模拟干细胞分化的特定微环境[11]。本研究制备的DBM表现出非常低的细胞残留,这与已有的相关研究结果一致[12]。不同的是,在本研究中,我们为了让OBs分泌的ECM与DBM共同模拟骨形成的微环境,将OBs接种在DBM的表面。在此过程中,OB显示出优异的增殖能力并分泌丰富的ECM蛋白,但同时也再次带来了免疫原性的风险,因此需要再次进行脱细胞处理。再次脱细胞处理后,H&E染色和DNA含量检测的结果证明OBDBM中的细胞几乎被完全除去。同时,SDS-PAGE结果显示OB-ECM也被很好的保留了下来。此外,细胞相容性也是本研究中OBDBM的生物学特性评价指标之一。以前的研究表明,DBM细胞毒性低,可以促进细胞增殖[13]。在本研究中,MTT实验的结果也证实了DBM和OBDBM具有相似的,良好的细胞相容性。OBs分泌的基质蛋白被认为是骨发育的重要成员。通过SDS-PAGE发现DBM和OBDBM之间总蛋白有明显的差异。 DBM仅保留了具有高分子量的蛋白质,从条带位置来看,可以判断DBM中主要是胶原蛋白,而OBDBM含有更为丰富的蛋白质条带,具有更宽的分子量范围。我们可以猜测OBDBM具有更多非胶原类蛋白,也正是这些大量的非胶原类蛋白模拟了骨发育的微环境。 BMSCs是一种多潜能的非造血骨髓细胞,通常被用作受损骨再生的种子细胞[14]。以前的研究表明,在DBMs上培养的BMSCs有成骨分化的能力[15]。值得注意的是,由于保留了大量的ECM蛋白,OBDBMs组在rBMSCs中表现出更高的ON和ALP表达水平。而这些基因是干细胞成骨的必需标志[16]。因此,我们认为OBDBM在模拟骨发育微环境及促进干细胞成骨分化方面可能具有更大的优势。综上所述,我们制备了OBDBM并证实了其具备一系列良好的生物学特性,如低细胞残留,保存完好的ECM蛋白,良好的细胞相容性和更强的骨诱导性。然而,在这项工作中尚未分析植入体内后OBDBM的性能表现。因此,后续的研究将关注OBDBM用于骨缺损的修复的效果。5结论本研究证实,OBDBM可保留较多的OB-ECM,具有低的细胞残留。与DBM相比,对于rBMSC的成骨分化促进作用更强。因此,本研究认为OB-ECM可以用作修饰支架材料的工具,OBDBM也有望作为骨重建的生物支架应用于骨组织工程研究中。参考文献[1]Hinsenkamp M, Collard JF. Growth factors in orthopaedic surgery: demineralized bone matrix versus recombinant bone morphogenetic proteins. Int Orthop. 2015;39:137-47.[2]Ramis JM, Calvo J, Matas A, Corbillo C, Gaya A, Monjo M. Enhanced osteoinductive capacity and decreased variability by enrichment of demineralized bone matrix with a bone protein extract. J Mater Sci Mater Med. 2018;29:103.[3]Johnson TB, Siderits B, Nye S, Jeong YH, Han SH, Rhyu IC, et al. Effect of guided bone regeneration on bone quality surrounding dental implants. J Biomech. 2018;pii: S0021-9290(18)30676-6.[4]Blair HC, Larrouture QC, Li Y, Lin H, Beer-Stoltz D, Liu L, et al. Osteoblast differentiation and bone matrix formation in vivo and in vitro. Tissue Eng Part B Rev. 2017;23:268-80.[5]Griffin MF, Butler PE, Seifalian AM, Kalaskar DM. Control of stem cell fate by engineering their micro and nanoenvironment. World J Stem Cells. 2015;7:37-50.[6]Souza ATP, Freitas GP, Lopes HB, Ferraz EP, Oliveira FS, Beloti MM, et al. Effect of cell therapy with allogeneic osteoblasts on bone repair of rat calvaria defects. Cytotherapy. 2018;20:1267-1277.[7]Fujisawa R, Tamura M. Acidic bone matrix proteins and their roles in calcification. Front Biosci (Landmark Ed). 2012;17:1891-903.[8]Van de Putte KA, Urist MR. Osteogenesis in the interior of intramuscular implants of decalcified bone matrix. Clin Orthop Relat Res. 1965;43:257-70.[9]He F, Chen X, Pei M. Reconstruction of an in vitro tissue-specific microenvironment to rejuvenate synovium-derived stem cells for cartilage tissue engineering. Tissue Eng Part A. 2009;15:3809.[10]You L, Weikang X, Lifeng Y, Changyan L, Yongliang L, Xiaohui W, et al. In vivo immunogenicity of bovine bone removed by a novel decellularization protocol based on supercritical carbon dioxide. Artif Cells Nanomed Biotechnol. 2018;4:1-11.[11]Wang CH, Wang TM, Young TH, Lai YK, Yen ML. The critical role of ECM proteins within the human MSC niche in endothelial differentiation. Biomaterials. 2013;34:4223-34.[12]Yang JL, Yao X, Qing Q, Zhang Y, Jiang YL, Ning LJ, et al. An engineered tendon/ligament bioscaffold derived from decellularized and demineralized cortical bone matrix. JJ Biomed Mater Res A. 2018;106:468-78.[13]Dozza B, Lesci IG, Duchi S, Della Bella E, Martini L, Salamanna F, et al. When size matters: differences in demineralized bone matrix particles affect collagen structure, mesenchymal stem cell behavior, and osteogenic potential. J Biomed Mater Res A. 2017;105:1019-33.[14]Qin Y, Wang L, Gao Z, Chen G, Zhang C. Bone marrow stromal/stem cell-derived extracellular vesicles regulate osteoblast activity and differentiation in vitro and promote bone regeneration in vivo. Sci Rep. 2016;6:21961.[15]Chen Y, Ye SH, Sato H, Zhu Y, Shanov V, Tiasha T, et al. Hybrid scaffolds of Mg alloy mesh reinforced polymer/extracellular matrix composite for critical-sized calvarial defect reconstruction. J Tissue Eng Regen Med. 2018;12:1374-88.[16]Esmailian S, Irani S, Bakhshi H, Zandi M. Biodegradable bead-on-spring nanofibers releasing beta-carotene for bone tissue engineering. Mater Sci Eng C Mater Biol Appl. 2018;92:800-6.
论文作者:陈硕,陈昌礼(通讯作者),陈玲
论文发表刊物:《中国保健营养》2019年第7期
论文发表时间:2020/1/17
标签:细胞论文; 基质论文; 蛋白论文; 相容性论文; 干细胞论文; 条带论文; 诱导论文; 《中国保健营养》2019年第7期论文;
