北京协和医院 北京 100001
摘要:背景:TKI目前已广泛用于EGFR突变型非小细胞肺癌肺癌患者。肿瘤样本可利用性和肿瘤本身的一致性仍是医生选择目标人群的难点。本研究通过使用MALDI-TOF质谱技术分析NSCLC患者服用TKI治疗前后血清蛋白变化,旨在探讨可能用于预测TKI治疗后出现耐药的血清多肽。方法:收集49例晚期NSCLC患者接受TKI治疗前后自身配对的血清样本98份,即服用TKI治疗前及疗效评价为进展后所采集的外周血血清。所有入选患者共分为2组:good组:PFS>6个月;poor组:PFS≤1个月。所有的患者对TKI治疗的最佳总疗效为疾病稳定或部分缓解。所有样本用弱阳离子微珠进行预分离后,在Bruker AutoflexTM基质辅助激光解析离子化-时间飞行质谱仪(MALDI-TOF-MS)上进行血清蛋白质谱检测。以ClinProTools(Version: 2.1)软件进行数据采集分析。结果: 分析整体49例样本治疗前后组自身配对差异多肽,两组数据用统计学软件得出有统计学意义(p<0.01)的差异多肽峰16个。在good组的24例样本中,治疗前后组自身配对聚类分析得出两组数据交叉确认值94.44%,区别率95.45%均为最高。两组数据用统计学软件得出有统计学意义(p<0.01)的差异多肽峰20个。Poor组的25例样本治疗前后组自身配对聚类分析得出两组数据交差验证值68.10%,识别率87.87%。后使用统计学软件未找到两组m/z在1,000 Da-10,000 Da范围内表达的有统计学意义的差异多肽峰。结论: 本研究发现在PFS>6个月的good组中,治疗前后血清蛋白质谱峰信号强度变化有统计学显著差异。在20个有明显统计学意义(p<0.01)的多肽峰,其代表的蛋白分子很可能与NSCLC患者产生TKI耐药或疾病进展相关。而PFS≤1个月的poor组,治疗前后血清蛋白质谱峰信号强度变化并无统计学差异。但鉴于本研究的病例数有限,需要进一步扩大样本量验证并检测分析并探索这些差异蛋白质的具体名称及具体的分子机制。
关键词:基质辅助激光解析电离飞行时间质谱 非小细胞肺癌 表皮生长因子-酪氨酸激酶抑制剂
以表皮细胞生长因子受体(epidermal growth factor receptor, EGFR)酪氨酸激酶抑制剂(tyrosine kinase inhibitor,TKI)为代表的靶向治疗是近些年非小细胞肺癌(nonsmall cell lung cancer, NSCLC)全身性治疗的重要进展之一。TKI的出现为晚期NSCLC患者的治疗带来新的治疗获益,然而多数对TKI有反应的患者最终仍会出现耐药而使得疾病进展[1-3],中位发生时间大约在6-12个月。如何预测在TKI治疗过程中患者出现进展,并调整治疗方案具有重要的指导意义。
蛋白质谱技术平台的进步使得自动化和高度平行检测分析血清蛋白质谱变化成为可能[4]。本研究以基质辅助激光解析离子化-时间飞行质谱仪(matrix-assisted laser desorption ionization time-of-flight mass spectrometry, MALDI-TOF-MS)分析EGFR-TKI治疗获益的NSCLC患者在治疗前后的血清蛋白质谱的变化,探索能够反映EGFR-TKI最终出现耐药时的血清标志物,为临床中EGFR-TKI的疗效监测及预测提供有效的候选血清标志物。
1.实验材料
1.1研究对象:
入组49例例晚期NSCLC患者接受TKI治疗前后自身配对的血清样本98份,即口服TKI前及临床评价为疾病进展后所采集的外周血血清。根据PFS情况分为两组:good组:PFS>6个月共24例;poor组:PFS≤1个月共25例。
1.2试剂
三氟乙酸(trifluoroacetic acid, TFA),乙腈(acetonitri le,CAN),α-氰基-4-羟基肉桂酸(α- c yano-4-hydroxycinnamic acid, HCCA),混合标肽,铜离子螯合纳米磁珠(MB-IMAC-Cu2+)及其缓冲液体系
1.3仪器
MALDI-TOF-MS(Ultraflex),MTP-Anchorpchip 靶(Var/384),台式离心机(LDZ5-2)磁珠分离器,ClinProTools 2.1 分析软件,MDF-382E(N) –80℃冰箱,-20℃冰箱,-4℃冰箱,Eppendorf 管,移液枪,液枪枪头
2.实验方法
2.1样本收集与处理:
(1) 患者晨起 8:00 空腹采集外周静脉全血 3ml 置于 EDTA 抗凝试管;
(2) 常温下静置 2h;
(3) 全血置于 4℃ 1,500r/min 离心 10min;
(4) 取上清液(血清)100 ul,-80℃冰箱保存以备用。
2.2金属螯合磁珠处理血清样品:
(1) 将铜螯合纳米磁珠混匀,取 5ul 磁珠及 50ul 结合液加入 Eppendorf 管,
放在磁珠分离器(MBS)上移动 4 次,仔细吸去悬浮的液体(注意磁珠在管中的运动),此步骤重复 3 次;
(2) 血清冰浴下解冻,加入 20ul 结合液和 5ul 血清,混匀,室温下静置 10min,编号;
(3) 将 Eppendorf 管放在 MBS 上移动 4 次,仔细吸去悬浮的液体;加入 100ul 洗涤液,在 MBS 上移动 4 次,直至液体清澈,弃去悬浮液;
(4) 再加入 100ul 洗涤液,在 MBS 上移动 4 次,仔细吸去悬浮的液体,此步骤重复 2次;
(5) 加入 20ul 洗脱液,混匀,室温静置 20min;
(6) 将 Eppendorf 管放置在 MBS 上移动 4 次后静置 20s直至液体清澈,将上清液移至新的Eppendorf 管内,完成样品处理过程,重新编号。
2.3 点靶及质谱检测
(1) 用已知相对分子质量的标准品进行MALDI质谱系统相对分子质量误差校正;
(2) Anchorchip 靶的清洗: 乙醇冲洗,50%甲醇( 200 mL 左右) 中超声10 min; 100% 甲醇中超声10 min; 纯水中超声10 min , 放在无尘纸上自然干燥;
(3) 吸取1 ul基质( 3 mg/mL HCCA, 50%乙腈, 2% 三氟乙酸) 点在晾干的样
品上, 然后室温下自然干燥后待检测( 若不能及时进行质谱检测, 则需放到4 ℃冰箱里进行保存);
(4) 将样品靶放入基质辅助激光解析串联飞行时间质谱(Bruker Ultraflex III MALDI-TOF/TOF-MS )进行分析。采用Smart-beam 激光器,200HZ 频率,线性、正离子模式下进行扫描。加速电压 1为 25kv,加速电压 2 为 23.5Kv,离子延迟提取 100ns,质量扫描范围为800-10,000Da,质谱信号单次扫描累加 500 次,每份血清样品一共累加 3,000 次;
(5) 采用外标法校正质谱峰,从而获得准确的由不同质荷比(mass-to-charge ratio,m/z)的多肽峰构成的血清多肽指纹谱。
2.4数据处理与分析
应用ClinProTools 2.1软件对MALDI-TOF质谱仪采集数据进行处理:首先进行Top H at Baseline 基线处理和Savitsky Golay Smoothing 平滑处理, 并过滤掉信噪比< 4 的峰, 将数据校正和归一化( TIC 总离子流) 。应用峰面积作为选用蛋白峰量化指标, 得到处理后图谱。将所得到的差异蛋白峰, 选择应用算法, 组成最佳的组合模式用于验证, 测算敏感性和特异性。
3. 实验结果
3.1 NSCLC患者整体自身配对血清差异多肽分析结果
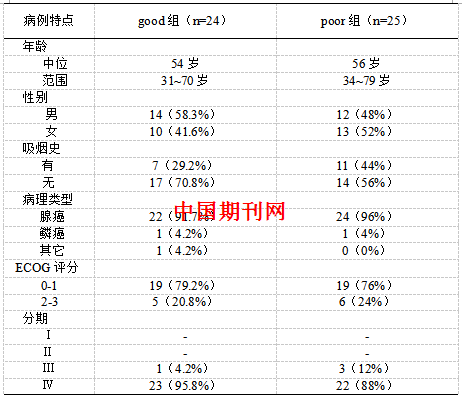
3.1.1 NSCLC患者整体疗前组疗后组血清多肽指纹图谱的获得 应用ClinProTools 2.1软件对MALDI-TOF质谱仪采集数据进行处理,得出整体疗前组与疗后组血清差异多肽指纹图谱,见图1。
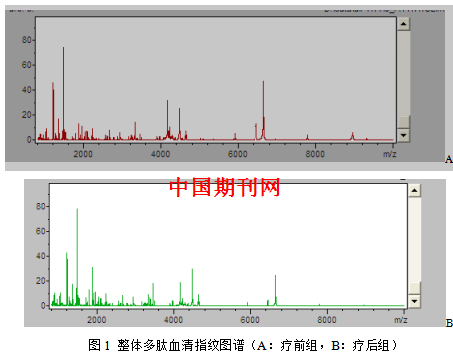
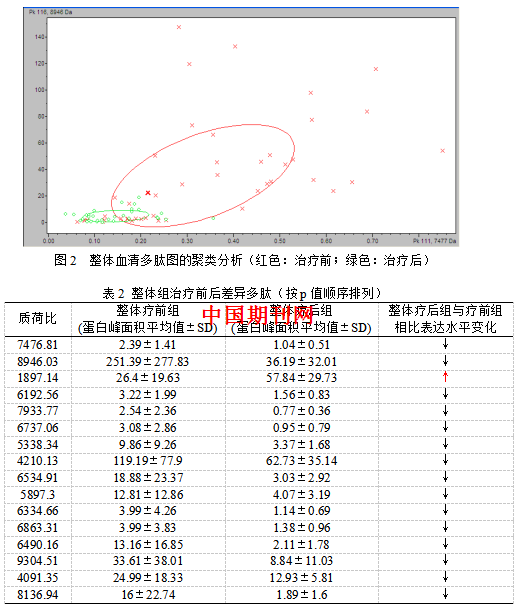
3.1.2整体自身配对间差异多肽的分析 利用CPT软件进行聚类分析(图2),对整体组治疗前与治疗后的血清多肽指纹图谱进行对比分析。得出两组数据交叉确认值74.94%,识别率88.50%。整体组自身配对的血清多肽指纹图谱经CPT软件分析后共鉴定出多肽峰118个。定义两组间P<0.001的多肽峰具有统计学差异,共找到两组m/z在1,000 Da-10,000 Da范围内表达的差异多肽峰16个,具体结果见表2。
3.2 good组患者整体自身配对血清差异多肽分析结果
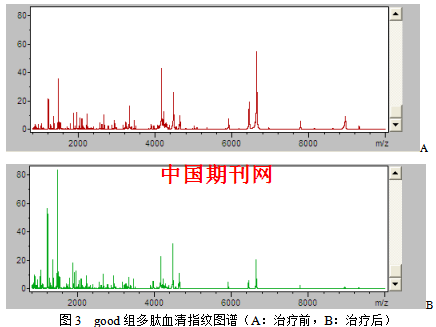
3.2.1 good组患者治疗前后血清多肽指纹图谱的获得 应用ClinProTools 2.1软件对MALDI-TOF质谱仪采集数据进行处理,得出good组治疗前后血清差异多肽指纹图谱,见图3。
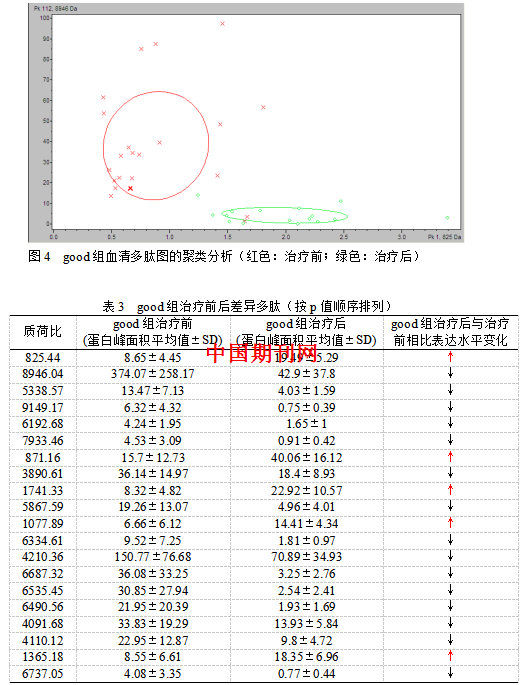
3.2.3good组治疗前后自身配对间差异多肽的分析 利用CPT软件进行聚类分析(图4),对good组治疗前后的血清多肽指纹图谱进行对比分析。得出两组数据交叉确认值94.44%,区别率为95.45%。poor组自身配对的血清多肽指纹图谱经CPT软件分析后共鉴定出多肽峰114个。定义两组间P<0.001的多肽峰具有统计学差异,共找到两组m/z在1,000 Da-10,000 Da范围内表达的差异多肽峰20个,具体结果见表3。
3.3poor组患者整体自身配对血清差异多肽分析结果
3.3.1 poor组患者治疗前后血清多肽指纹图谱的获得 应用ClinProTools 2.1软件对MALDI-TOF质谱仪采集数据进行处理,得出整体疗前组与疗后组血清差异多肽指纹图谱,见图5。
3.3.2 poor组治疗前后自身配对间差异多肽的分析利用CPT软件进行聚类分析(图6),对poor组治疗前后的血清多肽指纹图谱进行对比分析。得出两组数据交差验证值68.10%,识别率87.87%。poor组自身对照的血清多肽指纹图谱经CPT软件分析后共鉴定出多肽峰108个。定义两组间P<0.001的多肽峰具有统计学差异,未找到两组m/z在1,000 Da-10,000 Da范围内表达的差异多肽峰。此结果表明poor组疗前疗后两组数据没有良好的区分度,未能得出有统计学意义的差异蛋白峰。

4 实验讨论
磁珠辅助基质辅助激光解析电离飞行时间质谱(MALDI-TOF-MS),是一种高准确性、高通量、快速的检测手段,目前已广泛用于分析多种生物样本,如血清、尿液及组织等[1]。MALDI-TOF质谱技术结合生物信息学分析方法目前已广泛使用于乳腺癌[2]、膀胱癌[3-4]及头颈部癌症[5-6]的早期检测中。
近年来,多篇文献报道使用MALDI-TOF检测患者血清,建立分类模型,用以预测肺癌患者TKI治疗效果。Taguchi等[7]利用MALDI-TOF检测139例接受TKI治疗的NSCLC患者治疗前的血清。研究结果显示,通过该方法建立的VeriStrat模型可以有效地将使用TKI治疗的96例患者分为“好”(good,中位生存期为306天)和“差”(poor,中位生存期为107天)两组,且这两组EGFR-TKI治疗后的TTP也有明显差异,“好”组和“差”组分别为3.2个月和1.9个月(HR=0.53,95%CI=0.33-0.85, Log-rank,P=0.007)。该模型在多中心证实有良好的重复性,可通过检测TKI治疗前患者血清,鉴定TKI获益人群。Wu等[8] 的实验对象为68名使用TKI进行二线或三线治疗的NSCLC患者TKI治疗前血请。68名患者随机分为训练组与测试组。首先使用MALDI-TOF检测训练组血清,建立由3个多肽组成的分类模型。使用该模型盲法将44例测试组血清分为 “好”组与“差”组的准确性为93%。“好”组的OS与PFS明显高于“差”组。该实验进一步证实了使用蛋白分级算法预测NSCLC患者TKI治疗效果的可行性。
然而,对于TKI治疗后血清蛋白组学改变情况缺乏系统深入分析。在现有文献中Lazzari[9]等将111例NSCLC患者使用TKI治疗基线、治疗过程中与治疗后的血清样本使用MALDI-TOF仪器分析,并按照VeriStrat标准将血清分为“好”与“差”两组。得出治疗基线“好”组的患者与“差”组患者相比,有更长的PFS和OS。然而,三分之一治疗基线分为“好”组的患者在治疗结束后分组转变为“差”,并且这些患者均出现了新部位的进展。该实验提示VeriStrat蛋白组学分类标准在治疗前后发生的改变与原发性或获得性TKI耐药相关。然而,对于治疗前后自身配对出现的差异蛋白并未给出具体分析。 杨雪宁等[10]收集9例晚期NSCLC患者接受吉非替尼 (gefitinib)治疗前后自身配对的血清样本20份,即入组口服吉非替尼前及临床评价为疾病进展前两周所采集的外周血血清。所有的患者对吉非替尼的最佳总疗效评价为疾病稳定或部分缓解。所有样本用弱阳离子磁珠进行预分离后,在Bruker AutoflexTM公司MALDI-TOF-MS上进行血清蛋白质谱检测。以ClinProTools(Version: 2.1)软件进行数据采集分析。自身配对分析发现有7个血清蛋白质表达水平在肺癌患者耐药前后的血清中有统计学差异。两组实验均表明患者TKI治疗前后血清出现与耐药相关的差异蛋白。
本研究针对晚期NSCLC患者对TKI治疗前和临床疗效评价PD后血清样本的血清蛋白标志物进行差异分析。首先,分析整体49例样本治疗前后组自身配对差异多肽,在聚类分析图中可以看出,疗前组和疗后组有着较好的区分度。两组数据用统计学软件得出有统计学意义(p<0.01)的差异多肽峰16个。值得注意的是,疗后组与疗前组相比,15个差异多肽均表达下调,仅有质荷比为1897.14的多肽表达上调。在good组的24例样本中,治疗前后组自身配对聚类分析得出两组数据交叉确认值94.44%,区别率95.45%均为最高。说明good组区分度良好。两组数据用统计学软件得出有统计学意义(p<0.01)的差异多肽峰20个。Poor组的25例样本治疗前后组自身配对聚类分析得出两组数据交差验证值68.10%,识别率87.87%。后使用统计学软件未找到两组m/z在1,000 Da-10,000 Da范围内表达的有统计学意义的差异多肽峰。说明两组区分度较差。
本研究发现在PFS>6个月的good组中,治疗前后血清蛋白质谱峰信号强度变化有统计学显著差异。在20个有明显统计学意义(p<0.01)的多肽峰,其代表的蛋白分子很可能与NSCLC患者产生TKI耐药或疾病进展相关。而PFS≤1个月的poor组,治疗前后血清蛋白质谱峰信号强度变化并无统计学差异。但鉴于本研究的病例数有限,需要进一步扩大样本量验证并检测分析并探索这些差异蛋白质的具体名称及具体的分子机制。
5 结论
本研究针对晚期NSCLC患者对TKI治疗前和临床疗效评价PD后血清样本的血清蛋白标志物进行差异分析。应用MALDI-TOF-MS 技术检测血清多肽,并用ClinProt软件进行统计学分析,从整体角度和亚组角度得到了有统计学意义的差异蛋白峰。该结果对于TKI的耐药性研究具有无创、标本量少、简便、快捷、准确性高等优势,下一步我们需要在临床实际工作中扩大样本量进行验证,希望对建立非小细胞肺癌患者服用TKI耐药血清学研究奠定基础。
TKI目前已广泛用于EGFR突变型非小细胞肺癌肺癌患者。肿瘤样本可利用性和肿瘤本身的一致性仍是医生选择目标人群的难点。本文旨在利用MALDI-TOF分析患者血清,发现一种分计算法,用来预测患者服用TKI的效果。
越来越多的证据证明TKI,比如厄洛替尼,吉非替尼,作为晚期非小细胞肺癌的一线,二线和维持用药。然而,仅有一部分人群从TKI中获益。大量研究表明,EGFR激活突变是选择TKI获益人群的首要条件。然而,对实际临床遇到的复发或转移的NSCLC患者,获得足够数量的肿瘤组织用来检测十分困难。瘤内异质性和多线治疗后肿瘤特性的改变,对于检测准确性也有很大影响。
近期有研究报道EGFR基因突变可在血清基因组DNA或循环肺癌细胞中发现。这种检测结果缺乏一定可靠性和评判标准,并且因其费用昂贵不能广泛推广于临床。为解决这一问题,需要一种更为敏感和准确的检测方法,用来选择靶向药物的获益患者。
如今广泛认可蛋白表达可以更准确的预测疾病发展。并且,多种生物标记的组合与单一标记物相比,明显包含着更准确的诊断信息。近期许多实验室证明了使用蛋白组学的方法检测 从抗肿瘤治疗获益患者的可行性。
近年来,使用MALDI-TOF血清蛋白组学分级已发展成为预测疗效的方法。Taguchi等使用MALDI-TOF-MS检测出的8个蛋白信号组成VeriStrat算法,可以用来为晚期NSCLC患者治疗分级。
参考文献
[1]Villanueva J, Philip J, Entenberg D, et al. Serum peptide profiling by magnetic particle-assisted, automated sample processing and MALDI-TOF mass spectrometry. Anal Chem. 2004;76(6):1560–1570.
[2] Qiu F, Liu HY, Zhang XJ, Tian YP. Optimization of magnetic beads for MALDI-TOF MS analysis. Front Biosci (Landmark Ed). 2009;14: 3712–3723.
[3] Schwamborn K, Krieg RC, Grosse J, et al. Serum Proteomic Profiling in Patients with Bladder Cancer. Eur Urol. 2009;56(6):989–996.
[4]Villanueva J, Shaffer DR, Philip J, et al. Differential exoprotease activities confer tumor-specific serum peptidome patterns. J Clin Invest. 2006;116(1):271–284.
[5] Chang JT, Chen LC, Wei SY, et al. Increase diagnostic efficacy by combined use of fingerprint markers in mass spectrometry-plasma peptidomes from nasopharyngeal cancer patients for example. Clin Biochem. 2006;39(12):1144–1151.
[6]Freed GL, Cazares LH, Fichandler CE, et al. Differential capture of serum proteins for expression profiling and biomarker discovery in pre- and posttreatment head and neck cancer samples. Laryngoscope,2008,118(1):61–68.
[7]Taguchi F, Solomon B, Gregorc V, et al. Mass spectrometry to classify nonsmall-cell lung cancer patients for clinical outcome after treatment with epidermal growth factor receptor tyrosine kinase inhibitors: a multicohort crossinstitutional study. J Natl Cancer Inst, 2007, 99(11): 838-846.
[8]Wu X,Liang W,Hou X,et al.Serum proteomic study on EGFR-TKIs target treatment for patients with NSCLC[J].Onco Targets Ther,2013,6:1481-1491.
[9]Lazzari C, Spreafico A, Bachi A,et al.Changes in plasma mass-spectral profile in course of treatment of non-small cell lung cancer patients with epidermal growth factor receptor tyrosine kinase inhibitors[J].J Thorac Oncol,2012,7(1):40-48.
[10]杨学宁,张绪超,杨衿记,等.吉非替尼治疗前后肺腺癌患者血清蛋白质谱的变化[J].中国肺癌杂志,12(7):765-769.
[11]Carbone D. Serum proteomic prediction of outcomes in advanced NSCLC patients treated with erlotinib or placebo in the NCIC CTG BR.21 Trial. Presented at 2nd European Lung Cancer Conference, April 2010. J Thorac Oncol 2010;55:S80. Abstr. 2030.
[12]Chung CH, Seeley EH, Roder H, et al. Detection of tumor epidermal growth factor receptor pathway dependence by serum mass spectrometry in cancer patients. Cancer Epidemiol Biomarkers Prev 2010;19:358-365.
[13]Amann JM, Lee JW, Roder H, et al. Genetic and proteomic features associated with survival after treatment with erlotinib in first-line therapy of non-small cell lung cancer in Eastern Cooperative Oncology Group 3503. J Thorac Oncol 2010;5:169-178.
论文作者:贾和新 徐明静 刘珊珊
论文发表刊物:《临床医学教育》2017年8月
论文发表时间:2017/9/15
标签:血清论文; 多肽论文; 患者论文; 差异论文; 统计学论文; 蛋白论文; 两组论文; 《临床医学教育》2017年8月论文;
