1.南京中医药大学第一临床医学院 江苏南京 210046 2. 南京中医药大学第一临床医学院西医内科教研室 江苏南京 210046 3. 中国人民解放军第81医院全军肝病研究中心 江苏南京210002
摘要 目的:探讨南蛇藤乙酸乙酯提取物抗肝癌细胞hepG2及诱导其细胞凋亡作用。方法:倒置显微镜下观察南蛇藤乙酸乙酯提取物对肝癌细胞hepG2形态和生长抑制的影响。同时,用WST-8 法对药物作用细胞后细胞增殖进行定量。在此基础上用hoechst33342/PI(碘化丙啶)双重荧光染色法观察南蛇藤乙酸乙酯提取物诱导hepG2细胞凋亡作用,通过PI(碘化丙啶)对药物作用后的细胞染色,用流式细胞仪测定细胞凋亡DNA含量分布即细胞周期分析。结果:南蛇藤乙酸乙酯提取物对hepG2细胞有较强的抗肿瘤作用。南蛇藤乙酸乙酯提取物60μg/ml对hepG2细胞有明显诱导凋亡作用。
关键词 南蛇藤;提取物;hepG2;WST-8;hoechst33342/PI双重荧光染色;细胞周期分析;细胞凋亡
南蛇藤(Colastrus orbiculatus Thunb.)系卫矛科南蛇藤属植物,又名过山风、黄藤、苦树皮等。药用其根、藤茎和叶,分布广泛。该药始载于清代《植物名实图考》,药性辛温、有小毒,功效能祛风、活血、解毒、消肿。近几十年来对其化学和活性成分的研究发现,其主要含有倍半萜、三萜、黄酮,鞣质等成分,其中一些具有抗肿瘤和逆转肿瘤细胞多药耐药的活性[1,2]
刘延庆教授等人研究证明,南蛇藤乙酸乙酯提取物和正丁醇提取物是其抗肿瘤的有效成分[ 3,4]。本文研究了南蛇藤乙酸乙酯提取物对人肝癌细胞株hepG2增殖抑制及诱导凋亡作用。
1 实验材料
1. 1 试验药物
南蛇藤乙酸乙酯提取物,扬州大学刘延庆教授赠送。用DMSO 助溶,其最终浓度小于0. 05%(DMSO在此浓度下对细胞的生长无影响)。
1. 2 细胞株
人肝癌细胞株hepG2由中科院上海细胞所提供
1. 3 试剂
(1)DMEM高糖液体培养基(含25mmol/L Hepes 和2 mmol/L谷氨酰胺) 美国HyClong公司。
(2)胎牛血清 美国ExCell公司。
(3)二甲亚砜 美国Sigma公司。
(5)胰蛋白酶 美国Sigma公司。
(6)CCK-8试剂盒(主要成分WST-8)日本株式会社同仁化学研究所。
(7)Hoechst33324日本株式会社同仁化学研究所
(8)PI (碘化丙啶) 日本株式会社同仁化学研究所
(9)青霉素链霉素双抗溶液 美国HyClong公司。
(10)细胞培养液:含10%胎牛血清,100U·mL-1青霉素,100μg·mL-1链霉素的DMEM培养液。
(11)冻存液:为90%胎牛血清, 10%DMSO。
磷酸盐缓冲液(PBS):NaCl 8g、KCl 0.2g、Na2HPO41.56g、KH2PO4 0.2 g,加去离子水至1000ml,分装,高压灭菌后包扎瓶口,置4℃冰箱备用。
1. 4 主要仪器设备
倒置相差显微镜 日本OLYMPUS公司。 台式水平离心机 安徽科大创新公司。
超净工作台 苏州安泰公司。 CO2培养箱 美国NAPCO公司
MDF-1155ATN超低温冰箱 美国Revco公司。 SORVALL低温离心机 Biofuge stratos公司。
酶标仪 美国Bio-Rad公司。 无菌培养板、培养瓶 美国NUNC公司
高压锅(YXQSG41280)上海华线医用核子仪器有限公司 电子天平上海第二天平仪器厂
实验方法
2.1.人肝癌细胞HepG2和Hep3B培养及收集
将肝癌细胞HepG2和Hep3B按1×105/ml的密度接种在含10%胎牛血清的DMEM(含100U/ml的青霉素和100U/ml的链霉素)培养瓶内,置入37℃、5%CO2 培养箱,按1:3的比例2天传代1次。所有实验均在细胞对数生长期进行。
2. 2.倒置显微镜下hepG2细胞形态学观察
将处于对数生长期的细胞接种于6孔板中,待细胞生长至约80%时, 加入含不同浓度的南蛇藤提取物培养基100μl/孔,终浓度分别为120、60、30、15μg/ml;同时设空白对照组,于37℃、5%CO2培养箱中分别继续培养24、48和72h,在六孔板上标记一处后,分别在药物作用24h、48和72h后在倒置显微镜下观察。
2.3.WST-8 法检测南蛇藤提取物对人肝癌细胞HepG2的生长抑制作用
人肝癌细胞HepG2和Hep3B接种于96孔培养板中(每孔5×104个)培养12h,弃培养基,加入含不同浓度的南蛇藤提取物培养基100μl/孔,终浓度分别为120、60、30、15μg/ml;同时设空白对照组,每个浓度设3个平行复孔,于37℃、5%CO2培养箱中分别继续培养24、48小时,然后每孔加入WST-8 10μl, 继续培养1h后,酶标仪检测450nm的吸光度值(OD450值),计算药物的对细胞的生长抑制率。
细胞生长抑制率(%)=(对照组OD值-用药组OD值)/对照组OD值×100%
以浓度的对数为X轴,抑制率为Y轴,绘制细胞生长抑制曲线,估算IC50。
2.4. Heochst 33342/PI双染色法
用PBS制备30μM的hoechst33342染液,按1:9的溶液比例加入到12孔板中即100μl hoechst33342和5μlPI,895μl培养液;37℃下孵育细胞10分钟,将玻片取出,小心用PBS洗涤细胞2次,荧光显微镜460nm激发波长观察。
统计学分析
采用SPSS17. 0 软件对实验数据进行处理,并用并用单因素方差分析和t 检验进行统计分析,以P < 0. 05 为差异有统计学
意义。
实验结果
1、倒置显微镜下hepG2细胞形态学观察
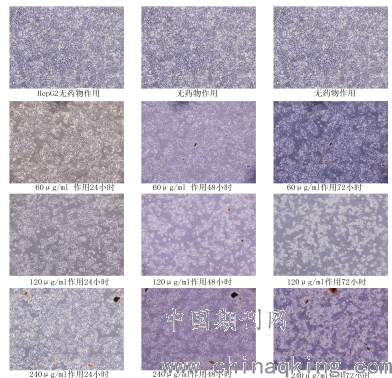
上图为100×,从图中可以看到南蛇藤提取物60μg/ml组中,对hepG2细胞作用24小时,细胞轮廓较清晰,形态变化不明显,胞体折光性较好,细胞突起明显;当作用48小时后,少部分(<5%)hepG2细胞核固缩,细胞突起减少,胞体折光性弱,胞浆内有颗粒;当作用72小时较48小时,细胞形态变化为甚。南蛇藤提取物120μg/ml组中,对hepG2细胞作用24小时,即可见到少部分(<5%)hepG2细胞核固缩,细胞突起减少,胞体折光性弱,胞浆内有颗粒与60μg/ml作用72小时程度近似;当作用48小时后,约70% hepG2细胞核固缩,细胞突起减少,胞体折光性弱,胞浆内有颗粒;当作用72小时后,几乎100%细胞发生明显形态学变化。南蛇藤提取物240μg/ml组中,对hepG2细胞作用24小时,即可见到部分(约5%)hepG2细胞核固缩,细胞突起减少,胞体折光性弱,胞浆内有颗粒没有120μg/ml作用48小时程度明显;当作用48小时后,约85% hepG2细胞核固缩,细胞突起减少,胞体折光性弱,胞浆内有颗粒;当作用72小时后,几乎全部细胞发生明显形态学变化。(图中褐色物质是无法完全溶解的药物)
2、WST-8 法检测南蛇藤提取物对人肝癌细胞HepG2的生长抑制作用
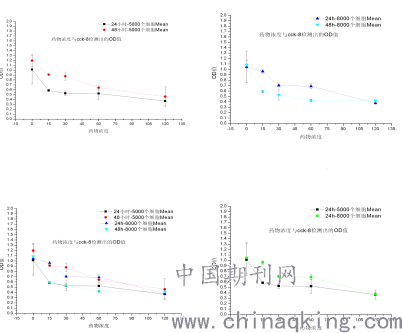
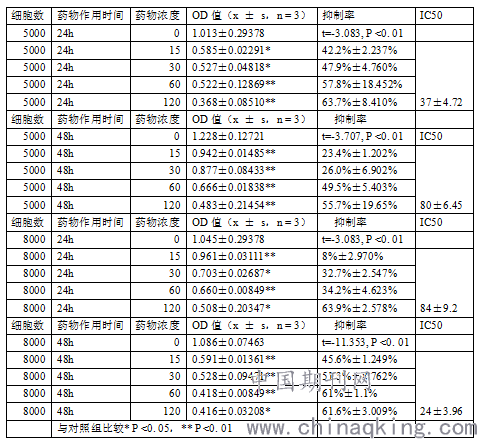
3.Heochst 33342/PI双染色法
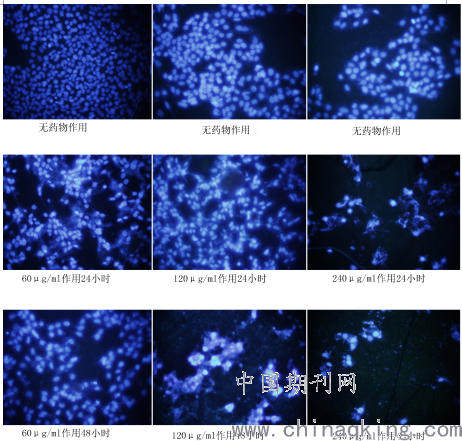
从图中可以看到南蛇藤提取物无药物组中细胞核的Hoechst着色的形态呈圆形,淡兰色,内有较深的兰色颗粒,不被PI染色(为正常细胞)。60μg/ml组中,对hepG2细胞作用24小时,约50%细胞核大部分由于浓集而呈亮兰色(为凋亡细胞)。当作用48小时后,少部分(<20%)hepG2细胞PI着色,还可以看到大部分(<60%)核呈分叶,碎片状,边集。南蛇藤提取物120μg/ml组中,对hepG2细胞作用24小时,即可见到一部分(<25%)hepG2细胞PI着色,还可以看到大部分(<70%)核呈分叶,碎片状,边集。当作用48小时后,约80% hepG2细胞核PI着色,细胞核形态模糊,较多的细胞碎片;当南蛇藤提取物240μg/ml组中,对hepG2细胞作用24小时作用和48小时,细胞核形态模糊,较多的细胞碎片。
讨论
日本同仁化学研究所开发研制的细胞活性计数试剂盒CCK-8( cell counting kit 8) , 其中的WST-8 试剂含有2-( 2-methoxy-4-nitrophenyl )-3-( 4-nitrophenyl) -5-( 2, 4-disulfophhenyl) -2 四唑一钠盐(WST-8) 和电子载体1-Methoxy PMS。CCK-8 活细胞计数试剂盒的原理是在活细胞代谢过程中, WST-8 在电子还原受体1-methoxy PMS 存在时, 会被活细胞中的还原酶还原为高度水溶性的黄色甲染料。[5]
生成的甲物的数量与活细胞的数量成正比, 甲物的数量可用在450 nm 处的吸光度来衡量, 可作为一种准确的细胞增殖和毒性分析的手段, 以下简称WST-8 法。CCK-8检测涉及细胞内的大多数脱氧酶。WST-8 法较MTT 法更加简便、高效、可重复性高。本实验选用与临床结合紧密的人肝癌hepG2进行细胞毒试验,结果南蛇藤乙酸乙酯提取物对上述细胞均有明显的细胞毒性,在120μg /ml 时,细胞的抑制率均大于50%,其中IC50 < 120μg /ml。同时,仔细分析细胞群落和用药的量对肿瘤细胞的增殖都有影响,当细胞在药物干预开始时,部分肿瘤细胞仍在增殖。当肿瘤细胞增殖到一定程度时,也有可能抑制细胞的增殖。
荧光染料 Hoechst 33342 只有少量能透过细胞膜进入细胞,使其染上低蓝色。但是当细胞发生凋亡时,它的细胞膜通透性增强,因此进入凋亡细胞中的Hoechst 33342 比正常细胞的多,荧光强度要比正常细胞中要高。此外,凋亡细胞的染色体DNA 的结构发生了改变,从而使该染料能更有效地与DNA 结合,并且凋亡细胞膜上的p-糖蛋白泵功能受到损伤不能有效地将Hoechst 33342 排出到细胞外使之在细胞内积累增加等都使凋亡细胞的蓝色荧光增强。本实验显示南蛇藤乙酸乙酯提取物在60μg/ml 时即有明显诱导肿瘤细胞凋亡的作用。并且在显微镜下可见较多的细胞碎片,考虑为细胞凋亡后继发性坏死所致,由于碎片无法计数。
参考文献
[1]Chang FR, Hayashi K, Chen IH, et al. Antitumor agents. 228. Five new agarofurans, reissantins A-E, and cytotoxic p rincip lesfrom Reissantia buchananii. J Nat Prod, 2003, 66(11): 1416-1420.
[2]Nagase M, Oto J, Sugiyama S, et al. Apoptosis induction in HL-260 cells and inhibition of topoisomerase Ⅱ by triterpene celastroll. Biosci Biotechnol Biochem, 2003, 67(9):1883-1887.。
[3]张舰,许运明,王维民,等. 南蛇藤提取物体内抗肿瘤作用的实验研究.中国中药杂志,2006,31(18):1514-1516.
[4]张舰,许运明,刘延庆. 南蛇藤提取物体外抑瘤作用研究. 中药药理与临床,2006,22(3-4):99-101.
[5] Tominaga H, Ishiyama M, Ohseto F, et al. A water-soluble tetrazolium salt useful for colorimetri c cell viability assay. Anal Commun, 1999, 36: 47-50.
论文作者:熊熙 汪茂荣 朱俊峰
论文发表刊物:《临床医学教育》2017年12月
论文发表时间:2018/2/2
标签:细胞论文; 提取物论文; 乙酸乙酯论文; 作用论文; 细胞核论文; 肝癌论文; 凋亡论文; 《临床医学教育》2017年12月论文;
