(上海市水产研究所水产品加工与饲料研究室 上海 200433)
【摘要】以水产加工废弃物罗非鱼皮为原料,提取纯化非变性胶原蛋白,获得相关技术参数:5%NaCl溶液和0.1mol/L NaOH溶液进行鱼皮前处理;1:50料液比的0.5mol/L乙酸溶液抽提两次得到酸溶性胶原蛋白;0.1%~0.2%胃蛋白酶,酶解后得到酶溶性胶原蛋白;分级过滤、盐析、透析对胶原蛋白进行纯化处理;冻干后鱼皮胶原蛋白的得率达到11%以上,适合进行产业化推广。
【关键词】罗非鱼皮;提取;纯化;非变性胶原蛋白;方法
【中图分类号】R914 【文献标识码】A 【文章编号】2095-1752(2018)32-0376-02
天然高分子胶原来源广泛,可以从陆生动物如猪、牛的皮、骨、腱等部位获取,也可以从水生动物中如鱼皮鳞中获取。由于陆生生物安全性问题日益受到人们的关注,很多国家和地区都限制了陆生生物来源胶原蛋白制品的使用范围,而水生生物的皮、骨、鳍等含丰富的胶原蛋白, 被国内外学者认为是安全的胶原蛋白来源。本项目组以水产加工废弃物罗非鱼皮为原料,通过原料前处理、胶原提取、胶原纯化等方法的研究,探讨罗非鱼皮非变性胶原蛋白的产业化路线。
1.材料与方法
1.1 原料前处理
1.1.1从水产养殖厂购买新鲜罗非鱼皮,清洗去鳞取皮,去除附着鱼肉和鱼鳍,切成2cm*2cm小块,备用。
1.1.2适量浓度的NaCl溶液清洗鱼皮,料液比1:10(w/v),4 ℃以下,每隔12hr更换一次溶液,重复4次。
1.1.3再更换0.1mol/L的NaOH溶液清洗鱼皮,料液比1:10(w/v)4℃以下,每隔12hr更换一次碱液,重复4次,再用去离子水反复清洗至pH6.5~7。
1.2 提取粗胶原
1.2.1酸溶性胶原的提取 将前处理后的鱼皮放入0.5mol/L的乙酸溶液中,料液比1:20(w/v),缓慢搅拌6hr后,过滤,取上清。重复上述酸溶步骤一次,合并滤液获得酸溶性胶原ASC(acid-soluble collagen)。
1.2.2酶溶性胶原的提取 1.2.1中过滤所得滤液中加入0.2%的胃蛋白酶,4℃酶解48hr,即获得胃蛋白酶水解胶原PSC(pepsine-soluble collagens)。
1.3 胶原的纯化
1.3.1分级过滤 将酶溶性胶原溶液经多次膜过滤,去除少量杂质。
1.3.2盐析 将滤液里加入饱和NaCl溶液至终端浓度为4%,静置4hr,4℃离心30min,10000g,取沉淀的胶原。
1.3.3透析 将盐析获得的胶原沉淀重新溶于纯水或稀酸中,控制适当的料液比,轻微搅拌(80rpm),装入100KD截留分子量的透析袋中,透析外液为纯水。
1.3.4冻干 将经透析纯化的胶液用-60℃冷冻干燥机冻干。
1.4 得率计算
2.实验结果与讨论
鱼皮的表皮起源于外胚层,鱼皮薄而柔软,角质化程度低,鱼皮的前处理与陆栖动物不同。鱼皮组织结构比较松散,脂肪和色素的含量较高,且不同种的鱼皮的组织结构、色素脂肪有较大差异,所以加工工艺有所不同。鱼皮中的结构蛋白主要为胶原蛋白,占80%以上,还有少量弹性蛋白和角蛋白。
本项目组对罗非鱼皮主要化学成分进行了检测:水分67.4%,灰分1.3%(湿基),蛋白质28.4%(湿基),脂肪1.1%(湿基),这些基本成分与叶小燕(2008)所测得的数据基本相似。
2.1 关于鱼皮前处理
由于鱼皮表面有色素、粘液等非胶原蛋白成分,我们选择了NaCl作为清洗剂清洗鱼皮。为了获得最佳的清洗浓度与实践,本项目组设计了单因素实验,即分别以3%,5%,8%浓度的NaCl溶液清洗鱼皮60hr,每12hr更换一次同浓度NaCl溶液,并抽取清洗的液体,用紫外分光光度计检测A280处的吸光度,确定清洗程度。
.png)
图1 不同盐浓度清洗罗非鱼皮实验结果
由图1可以看出,三个浓度的溶液在12hr时清洗效果差异不大,但24hr后,3%的NaCl溶液清洗时吸光度一直保持在高位,历经60hr鱼皮仍未清洗干净。5%和8%浓度的NaCl溶液清洗在逐步递减,48hr和60hr的数据差异不大,肉眼观察清洗料液较清澈,判断在48hr时鱼皮已经清洗干净。
考虑到成本控制及污水处理等产业化生产需关注的问题,我们选择5% NaCl溶液作为清洗剂,每12hr更换一次溶液,清洗48hr,作为盐洗操作参数。
盐洗后,为了利于胶原的浸出,我们选择0.1mol/L NaOH 溶液进行清洗鱼皮,既能疏松胶原纤维之间的紧密连接又可去除鱼皮中的少量脂肪。碱洗操作参数定为:0.1mol/L NaOH溶液 1:10 料液比,清洗4次,每次12 hr。
2.2 关于提取胶原
胶原蛋白是酸溶性蛋白,本项目组选用0.5mol/L的乙酸溶液作为抽提剂。这一步是制备胶原蛋白的关键,直接影响着胶原蛋白的得率。我们采用四个抽提料液比,即1:30,1:40,1:50,1:60,鱼皮溶胀12hr后,轻微搅拌料液,纱网过滤,得到第一道胶液,胶液称重;获得的残渣再次分别加入乙酸溶液,第二次溶胀,12hr后过滤,得到第二道胶液,胶液称重。经过后续的酶解,纯化,冻干后,得到胶原蛋白干品,计算得率。
.png)
图2 不同浓度提取罗非鱼皮胶原蛋白得率
不同比例的抽提液较大的影响着胶原蛋白的得率。1:30实验组,第一道和第二道料液浓度分别为0.33%和0.31%,相差无几。可以认为,胶原蛋白在酸液中达到一定浓度后,就很难再浸出,只有通过提高酸液的体积来提高胶原蛋白的浸出。1:50比例实验组的料液浓度0.19%,虽然低于1:30和1:40实验组,但是总得率却高于这两组。1:60实验组总得率与1:50相差不多,因此,提高抽提液浓度不能无限扩大胶原的得率。
综上所述,本项目组确定的酸溶性胶原的提取工艺参数为前处理后的鱼皮经0.5mol/L乙酸溶液抽提两次,1:50料液比。
酸溶性胶原提取后,为了进一步降低其抗原性,更利于生物医用材料领域的利用,我们选择胃蛋白酶进行端肽酶切,获得低抗原胶原蛋白。经实验反复验证,我们选定0.1%~0.2%胃蛋白酶,在4℃条件下,酶解6hr~8hr为宜。
2.3 关于胶原蛋白的纯化
医用级胶原蛋白对产品的纯度有着极高的要求,纯度高于95%以上。因此,控制杂蛋白,提高胶原纯度始终贯穿于整个工艺路线中。
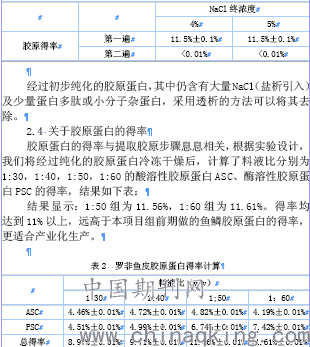
在酶溶性胶原酶解后,对胶原料液进行盐析。在稀酸条件下,胶原蛋白分子在1.0~2.0mol/LNaCl时能被沉淀。我们配置饱和NaCl溶液,缓慢加入料液中,边加边搅拌。分别设计两平行实验,一份中加入4%终浓度NaCl,一份中加入5%终浓度NaCl,结果显示,两者所得沉淀相差无几,可见4%浓度足够让胶原蛋白完全盐析。见表1。
表1 胶原蛋白料液盐析表
3.结论
3.1 鱼皮前处理
5%NaCl溶液作为清洗剂,1:10料液比,每12hr更换一次溶液,清洗48hr;0.1mol/L NaOH溶液1:10料液比,清洗4次,每次12hr。
3.2 提取粗胶原
0.5mol/L乙酸溶液抽提两次,0.1%~0.2%胃蛋白酶,在4℃条件下,酶解6hr~8hr。
3.3 胶原蛋白的纯化
分级过滤,使料液与黑色素、杂质等分离;对胶原料液进行盐析4%终浓度NaCl对胶原料液进行盐析;透析进一步纯化。
3.4 鱼皮胶原蛋白的得率达到11%以上,鱼鳞胶原蛋白的得率仅为5%,因此鱼皮胶原蛋白的制备更适合推广产业化生产。
【参考文献】
[1]蒋大挺.胶原与胶原蛋白.化学工业出版社,2006:1-30.
[2]顾其胜.实用生物医用材料.上海科技出版社,2005:144-145.
[3]叶小燕,余文国,吴文龙,曾根祥,黄丽明,等.罗非鱼皮营养成分分析及鱼明胶提取工艺探讨.南方水产,2008(4):56-60.
[4]王南平,何兰,吴文惠。黄鱼鱼鳞胶原蛋白制备和纯化方法的研究.中华航海医学与高气压医学杂志.2008,15(6):21-26.
[5]吴文惠,姝亚,包斌,等.温和条件分离马胶鲨皮胶原蛋白及其部分特性研究;中国海军医学与高气压研究杂志,2007(4):9-13.
[6]施惠群,邹胜祥,许文怡.海洋生物明胶,农业出版社,1982.
论文作者:王月林,何兰,郭休玉,陆雪荣
论文发表刊物:《医药前沿》2018年32期
论文发表时间:2018/12/12
标签:溶液论文; 胶原蛋白论文; 胶原论文; 浓度论文; 罗非鱼论文; 胃蛋白酶论文; 乙酸论文; 《医药前沿》2018年32期论文;
