1.贵阳中医学院第二附属医院内分泌科 贵州贵阳 550000 2.中南大学湘雅三医院 湖南长沙410000
摘要 目的:从2型糖尿病患者(T2DM)外周血中分离培养内皮祖细胞(endothelial progenitor cells,EPCs),并探讨其体外诱导培养的条件。观察黄芪多糖(Astragalus Polysaccharides,APS)对T2DM外周血EPCs增殖的影响。方法:密度梯度离心法获取外周血单个核细胞,在鼠尾胶原包被的培养瓶中培养7d后鉴定EPCs,MTT检测APS对T2DM EPCs增殖的影响。结果:T2DM外周血单个核细胞在鼠尾胶原包被的培养瓶中培养后呈梭形、铺路石样,表达内皮细胞的特异性抗原CD34和KDR,和干/祖细胞抗原CD133。APS在一定剂量和时间范围内能促进T2DM外周血EPCs增殖(P<0.05)。结论:鼠尾胶原可代替EPCs培养中常用的纤维连接蛋白,是体外分离培养外周血EPCs的更节省的一种方法。黄芪多糖(APS)能促进EPCs增殖。
关键词 黄芪多糖;内皮祖细胞;增殖
Abstract: Objective:To investigate the methods of isolating and culturing endothelial progenitor cells (EPCs)from peripheral blood in patients with type 2 Diabetes(T2DM).To observe the effect of APS on proliferation of EPCs from peripheral blood with T2DM.Methods:Total mononuclear cells were isolated by Ficoll density gradient centrifugation and put into the culture plate previously coated by rat tail collagen,After 7 days of culture,EPCs were characterized.EPCs were treated with various concentrations and different time culture of APS, the proliferation was measured by MTT.Results:Most of the cultured cells displayed fibroblast-like and slabstone-like morphology adhering to the culture plate.They expressed CD34, CD133 and KDR.They could show endocytosis of UEA-I and acLDL, too.APS could in a dose-and time-dependent manner promote the proliferation of EPCs in T2DM.Conclusion:The rat tail collagen can be a more cheaper replacement of the fibronectin to culture the EPCs from peripheral blood with T2DM.Treatment with APS can markedly promote the proliferation of EPCs in T2DM.
Key words:Astragalus Polysaccharides;Endothelial progenitor cell; proliferation
内皮祖细胞(EPCs)是一类能分化为血管内皮细胞的前体细胞,EPCs不仅参与人胚胎血管生成,也参与出生后血管新生和内皮损伤后的修复过程[1],EPCs的数量及功能紊乱在糖尿病血管并发症的发生发展中起关键作用。因此,EPCs可作为组织工程中血管的种子细胞来源。但EPCs在正常人骨髓及外周血循环中
数量较少,有研究结果显示,从人外周血单个核细胞中分离出来的EPCs仅为0.05%-0.1%[2]。其培养方法复杂,成本较高,给其研究带来不便。本研究在EPCs的培养中以自行制备的鼠尾胶原代替常用的纤维连接蛋白,并观察其培养细胞的效果,以期以最低的花费获得能构建组织工程血管的足够的种子细胞。我们的前期研究已经成功证实黄芪能促进正常及糖尿病条件下EPCs的增殖和分化[3-5],黄芪多糖(APS)是黄芪的主要活性物质,研究表明黄芪多糖(APS)具有保护胰岛β细胞、调节血糖及改善脂代谢和胰岛素抵抗的作用[6-12],但其对EPCs的影响目前未见报道。本研究通过观察APS对T2DM外周血EPCs增殖的影响,探讨黄芪多糖在糖尿病血管并发症治疗中的可能机制。
1. 材料
1.1 标本
T2DM的诊断参照1999年WHO诊断标准。T2DM患者20例,采集空腹外周血20ml/例。DM组均为住院患者,所有献血者均排除吸烟、近期外伤、手术史、皮肤溃疡、心血管、血液系统疾病等影响EPCs的因素。
1.2 药物与试剂
黄芪多糖粉针剂(天津赛诺制药有限公司,国药准字:Z20040086,批号:080901,每支250mg)。人淋巴细胞分离液(天津灏洋生物),M199培养基(Hyclone),胎牛血清(Gibco),VEGF、bFGF(PeproTech),FITC-UEA-I、Dil-acLDL(Sigma),MTT、DMSO、胰蛋白酶(Amresco),PE直标鼠抗人 CD133、FITC直标鼠抗人 CD34单克隆抗体、KDR单克隆抗体(R&D SYSTEMS),Sprague-Dawley大鼠购自中南大学湘雅医学院实验动物中心。
2. 方法
2.1 鼠尾胶原的制备:剪下SD大鼠鼠尾浸泡在75%酒精中30分钟后,在无菌双蒸水中反复冲洗2~3次,无菌条件下将鼠尾切成小段,抽出尾腱置平皿中,尽可能剪碎,将剪碎的肌腱浸入0.1%醋酸中(每50g尾腱加入100ml醋酸),置4℃冰箱中振摇48~72小时,使肌腱充分溶解成为胶原溶液。再移入无菌离心管内4000r/min离心30 min,取上清液分装入无菌小瓶,-20℃保存备用。
2.2 EPCs的分离、培养:密度梯度离心法获取单个核细胞,用5mlM199培养基(含20%胎牛血清、VEGF12ng/ml、bFGF 4ng/ml、青霉素100U/ml、链霉素100U/ml)重悬,铺在鼠尾胶原包被过夜的培养瓶内,培养4 d后换液,以后隔日换液培养至7天,收集贴壁细胞供实验用。
2.3 EPCs的鉴定:细胞与Dil-acLDL及FITC-UEA-I孵育后,激光共聚焦显微镜鉴定EPCs;流式细胞仪检测EPCs表面抗原标志,Cell Quest软件定量分析每管样品中5000个细胞,分析CD34、CD133和KDR的阳性表达百分率。
2.4 MTT实验观察黄芪多糖对内皮祖细胞(EPCs)的影响
用含不同浓度黄芪多糖组的M199培养基(黄芪多糖终浓度分别为50mg/l、200mg/l、800mg/l、3200mg/l 、6400mg/l)干预细胞,分别培养6、12、24、48小时。取490nm波长,在酶联免疫检测仪上测定各孔光吸收值(A值),记录结果。
3. 统计学处理 用SPSS 17. 0统计软件包进行数据处理,计量资料以表示,各组均数间比较采用ANOVA分析,P<0.05为差异有统计学意义。
4. 结果
4.1 EPCs的培养
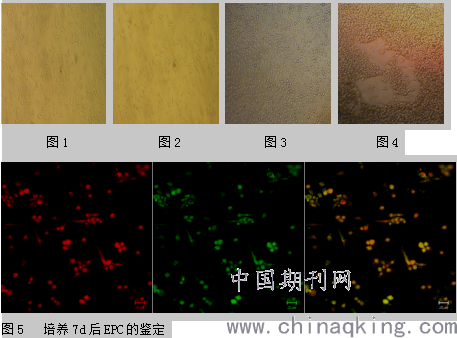
外周血单个核细胞接种于鼠尾胶原包被的培养瓶中,细胞大多呈悬浮生长,第2d可见少数细胞贴壁,第4 d 左右可以形成从中间向外放射的细胞集落,其上常附着少量圆形细胞;以后梭形细胞逐渐增多,7 d 时长成典型的长梭形、双极针状,并出现有的细胞首尾相连成条索状(图1、2)。培养第2 周时,梭形细胞开始消失,取而代之出现的是椭圆形细胞,呈鹅卵石样,有的细胞可形成管腔状结构(图3、4)。种植1.0×106MNCs的贴壁细胞数可达到6×104。
4.2 EPCs的鉴定
单个核细胞培养7天后通过激光共聚焦显微镜鉴定,细胞对Dil-acLDL摄取(红色,激发波长543nm)和与FITC-UEA-I结合(绿色,激发波长477nm),Dil-acLDL和FITC-UEA-I双染色阳性细胞被认为是正在分化的EPCs,见图5。流式细胞仪检测贴壁细胞表面标志,结果显示:贴壁细胞中,表达CD34占32.15±8.68%,表达CD133占18.73±7.12%,表达KDR占69.45±8.21%,见图6。4.3 MTT检测黄芪多糖对EPCs增殖的影响
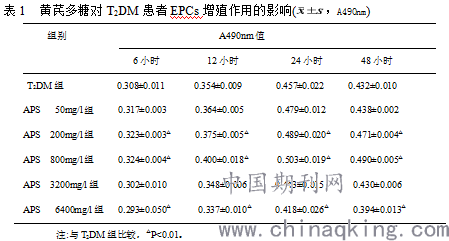
黄芪多糖显著增加内皮祖细胞的增殖能力,呈一定的量效关系与时效关系。MTT实验A值在50mg/l浓度时开始较对照组增加(P>0.05),在浓度为800mg/l时最为显著(P<0.01);EPCs的增殖能力在黄芪多糖刺激后6小时开始改善,于24小时达到高峰,48小时后有所下降,但仍然高于对照组(表1)。
单个核细胞培养7d后,通过激光共聚焦显微镜鉴定细胞对Dil-acLDL摄取(红色激发波长543nm)和与FITC-UEA-I结合(绿色,激发波长477nm),双染色阳性细胞(呈黄色)是正在分化的EPC。
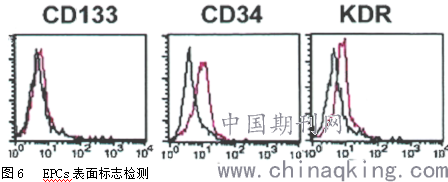
分离获得的单个核细胞培养7d后,流式细胞仪检测贴壁细胞表面标志,表达CD133:18.73±7.12%,CD34:32.15±8.68%,KDR:69.45±8.21%。
5. 讨 论
内皮祖细胞(EPCs)存在于骨髓、脐带血和外周血中,能增殖分化为成熟内皮细胞,对内皮损伤后的修复起着重要作用。糖尿病患者外周血EPCs数量减少,其增殖、迁移和成血管能力降低。设法增加EPC的数量并改善其功能可促进血管新生和再内皮化,为预防和治疗糖尿病血管并发症提供了新的治疗策略。
成人外周血EPCs含量极少,如何将EPCs进行体外扩增是关键。目前最常见的方法是将多种细胞因子按照一定的浓度比例加入培养体系中,从而达到更好促进EPCs的分化和增殖的作用。本研究采用了VEGF、bFGF细胞因子,结果发现EPCs的分化和生长状态良好。初始贴壁生长的EPCs逐渐形成长梭形,但增殖缓慢;在第2周左右,开始出现铺路石样细胞,增殖较快。这与Gulati等[13]的实验结果相一致。研究发现 EPCs可来源于成人外周血单个核细胞的 CD14+和CD14-细胞亚群,其中大部分短期培养贴壁的是CD14+单核细胞,于原代培养4~7d出现,呈长梭形、双极针状,集落样聚集生长,于培养3~4周后基本不再增殖并逐渐凋亡。真正的祖细胞可能源于其它很少的一部分CD14-细胞,命名为晚期生长细胞,培养后约于2~3周时开始出现,呈铺路石样形态,有较强的增殖能力,能持续稳定增殖12 周以上[14]。此外,本研究使用了鼠尾胶原,而没有用纤维连接蛋白。结果发现也能获取较多的EPCs,但其成本却大大减低。纤维连接蛋白是基质中一种糖蛋白,主要起促进细胞贴壁的作用。鼠尾胶原主要成分为I型胶原,具有成本低廉、取材方便和黏附力强等优点,很多作者将鼠尾胶用于培养微血管内皮细胞、人脐静脉内皮细胞、脑星形胶质细胞、皮肤角朊细胞和前庭毛细胞等。宋晓红等[15]以鼠尾胶原为为贴黏剂建立了人鼻腔纤毛上皮细胞培养模式。由于许多细胞在I型胶原中培养可获得与机体相似的组织形态,如颌下腺上皮细胞、乳腺上皮细胞可分别增殖分化形成腺管样结构,因此鼠尾胶也常被用于管状结构新生模型的研究。李明焕等[16]发现在鼠尾胶中,人脐静脉内皮细胞在生长因子的刺激下,可以形成树枝状毛细血管样结构;章必成等[17]以鼠尾胶原为贴黏剂成功培养了小鼠淋巴管内皮细胞,并具有形成淋巴管样结构的能力。
近年研究发现GM-CSF、G-CSF、VEGF、他汀类、雌激素、ACEI、EPO等动员骨髓释放EPC并使其功能正常化。黄芪多糖(APS)是黄芪的主要活性物质,研究表明APS能使人外周血单核细胞(PBMC)产生 G-CSF 和 GM-CSF等造血细胞因子,并呈量效时效关系[18];APS 能有效地促进小鼠和人骨髓和外周血造血干/祖细胞的增殖[19-20]。EPCs和造血干细胞来源于共同的祖细胞,均由成血管细胞分化而来。基于EPCs和造血干细胞在发育上的密切关系,推测APS可能影响EPCs的数量及功能。本研究证实了APS在一定范围内呈剂量和时间依赖性地促进EPCs增殖。可见APS不仅具有保护胰岛β细胞,调节血糖,改善脂代谢和胰岛素抵抗的作用[6-12];可能还通过促进EPCs的增殖、分化,促进内皮修复,在治疗糖尿病血管并发症中发挥重要作用。
综上所述,本研究建立了一种培养扩增人外周血中EPCs的简便且低成本的方法,期待能为EPCs在组织工程中的应用提供充足的细胞。黄芪多糖可能通过促进T2DM患者外周血EPCs的增殖、分化,达到糖尿病血管并发症的目的,但具体机制还有待进一步深入的研究来阐明。
参考文献
[1] Hill JM,Zalos G,Halcox JP,et al.Circulating endothelial progenitor cells,vascular function,and cardiovascular risk[J].N Engl JMed,2003,348:593-600.
[2] REYES M, DUDEK A, JAHAGIRDAR B, et al.Origin of endothelial progenitors in human postnatal bone marrow[J].J Clin Invest,2002,109:337-346.
[3] Aicher A, Heeschen C, Mildner-Rihm C,et al.Essential role of endothelial nitric oxide synthase for mobilization of stem and progenitor cells[J].Nat Med,2003,9(11):1370-1376.
[4] 徐寒松,雷闽湘,刘泽灏,等.黄芪对人外周血内皮祖细胞增殖及细胞周期的影响[J].中医杂志,2008,49(2):160-166.
[5] 徐寒松,雷闽湘,孔德明,等.黄芪对2型糖尿病外周血内皮祖细胞增殖、分化的影响[J].中华中医药杂志(原中国医药学报),2009,24(2):234-237.
[6] Werner N,Nickenig G.Clinical and therapeutical implications of EPC biology in atherosclerosis[J].J Cell Mol Med,2006,10(2):318-332.
[7] 陈蔚,李益明,俞茂华,等.黄芪多糖对糖尿病鼠T 细胞亚群的免疫调节作用[J].中国现代医学杂志,2007,17(1):28-31.
[8] 李如江,邱曙东,陈红霞,等.黄芪多糖对1 型糖尿病小鼠胰腺β细胞总质量的影响[J].中国中药杂志,2007,32(20):2169-2173.
[9] 周云枫,吴勇,欧阳静萍.黄芪多糖对2 型糖尿病大鼠肾组织胰岛素信号转导的影响[J].武汉大学学报(医学版),2005,26(2):139-142.
[10] 徐怡,王保华,李柯,等.黄芪多糖的胰岛素增敏作用及其对蛋白酪氨酸磷酸酯酶1B的影响[J].武汉大学学报(医学版),2010,31(3):288-291,308.
[11] 胡琛琛,毕会民,张叶敏,等.黄芪多糖对2型糖尿病大鼠肝脏CHOP表达的影响[J].微循环学杂志,2010,20(1):1~3,12.
[12] 陈蔚,陈雯洁,夏燕萍,等.黄芪多糖对糖尿病仓鼠脂代谢紊乱及心肌PPAR2α表达的影响[J].复旦学报(医学版),2010,37(2):194-197,215.
[13] Gulati R, Jevremovic D, Peterson TE, et al.Diverse origin and function of cells with endothelial phenotype obtained from adult human blood [J]. Circ Res,2003,93(11):1023-1025.
[14] Jin Hur,Chang-Hwan Yoon.Characterization of two types of endothelial progenitor cells and their different contributions to neovasculogenesis.Arterioscler Throm b Vasc Biol,2004;24(2):288-293.
[15] 宋晓红,张罗,韩德民,等.鼠尾胶原为底物的人鼻腔纤毛上皮细胞培养模式的建立[J].中国耳鼻咽喉头颈外科,2007,2(14):107-111.
[16] 李明焕,田铧,刘执玉,等.ECV304细胞用于三维血管新生的研究[J].中国现代普通外科进展,2004,7(3):165 - 167.
[17] 章必成,王俊,赵勇,等.以鼠尾胶为贴黏剂的小鼠淋巴管内皮细胞培养体系的建立[J].第四军医大学学报,2007,28 (5):390-393.
[18] 娄小芬,张炳华,宋京,等.黄芪多糖对有核细胞分泌造血因子的影响[J].中药新药与临床药理,2003,14(5):310-312.
[19] 张仲平,洪介民.黄芪多糖对体外人骨髓造血祖细胞生成的影响[J].中药药理与临床,2000,16(1):16-17.
[20] 翁玲,刘学英,刘彦,等.黄芪多糖对小鼠骨髓及外周血造血干细胞的增殖及动员作用[J].基础医学与临床,2003,(3):306-309.
论文作者:吴青1 徐寒松1 谢晓云2 陈文群1
论文发表刊物:《临床医学教育》2017年12月
论文发表时间:2018/2/2
标签:细胞论文; 黄芪论文; 多糖论文; 内皮论文; 胶原论文; 外周血论文; 血管论文; 《临床医学教育》2017年12月论文;
