徐国丽1 林娜2 薛乐珍2(通讯作者)
(1 江苏鼎泰药物研究所有限公司 211800)
(2 江苏省药物研究所/江苏省药物安全性评价中心 210009)
【摘要】目的 初步研究吸收性止血生物材料的生物相容性,为其在手术中应用的安全性做出评价。方法 将9只新西兰兔分为3组,即供试品-1组(6.25 mg/kg)、供试品-2组(12.5 mg/kg)和供试品-3组(25 mg/kg),每组3只,各组采用自身作为空白对照,通过皮下注射在动物背部植入吸收性止血生物材料,每个时间点1只动物,每侧4个皮下囊,在植入后第3、7、14天取皮下囊部位组织常规HE染色做病理检查。结果 大体观察残留程度0%;解剖时肉眼观察仅供试品-3组在植入后第3天其4号取材点可见皮下囊包块存在;病理镜检发现,各组皮肤表皮及真皮均无明显的病理改变,皮肤附件结构正常,皮下及周围组织也未见充血、水肿及炎细胞浸润,供试品-1和供试品-2组在各时间点均未见供试品残留,供试品-3组在植入后第3天和第7天其4号取材点可见供试品极轻度未吸收,第14天各取材点未见供试品残留。结论 6.25 mg/mL、12.5 mg/mL和25 mg/mL的吸收性止血材料在新西兰兔背部皮下很快被吸收,在机体内两周基本被降解,对于手术应用安全性颇佳。
【关键词】 吸收性止血生物材料 皮下植入 生物相容性
【中图分类号】R318 【文献标识码】A 【文章编号】2095-1752(2013)32-0116-02
吸收性生物止血材料作为变性淀粉材料,理论上讲其体内的分解是由组织、体液中广泛分布的淀粉酶来完成,最终产物为麦芽糖、葡萄糖和糊精等机体正常成分,能被机体利用或分解排出体外,具有很好的生物安全性[1, 2]。本研究将从吸收性生物止血材料植入新西兰兔背部皮下后吸收情况的角度,参考国家食品药品监督管理局的中华人民共和国医药行业标准(YY/T 0606.7-2008)对其生物相容性做出评价。
材料
1 供试品
吸收性止血生物材料,批号20110718,1 g/支,白色粉末,在显微镜下呈微孔多聚糖的颗粒,呈圆形或卵圆形,由江苏天麟生物医药科技有限公司提供。
2 实验动物
新西兰兔,体重2.0-3.0 kg,购自中国人民解放军第四军医大学实验动物中心【生产许可号SCXK-(军)2007-007】,饲养于托盘饲育架(300×210×55cm)上的悬吊式不锈钢饲育笼(40×40×50 cm)内,1只/笼,温度18~26℃,湿度40~70%,换气次数8~10次/小时,工作照明150~300 Lux,动物照明100~200 Lux,照明时间12小时/天(06:00~18:00),自由摄食与饮水,笼具每日清洁,托盘、食盆、饮水瓶每周更换消毒,试验结束后对笼具进行清洗消毒,落下菌数≤30个/皿。
3 主要试剂
乌来糖,批号T20110214,苯酚,批号T20100305,曙红Y,醇溶,F20080314,三者均由国药集团化学试剂有限公司生产;乙醇(无水),批号11122811707,乙醇(95%),批号11122211666,二甲苯,批号12020710153,三者均由南京化学试剂有限公司生产;甲醛溶液,批号1202282,西陇化工股份有限公司生产;正丁醇,批号0908101,上海申博化工有限公司生产;苏木色精,批号070525,上海科丰化学试剂有限公司生产;盐酸,20110109,扬州科力化工有限公司。
4 主要仪器
自动染色机,ST4040,Leica;半自动切片机,RM2245,Leica;全自动组织处理仪,TP1020,Leica;全自动包埋机,EG1140,Leica;生物病理显微成像系统,BX45-DP72,OLYMPUS;双人单面超净台,SW-CJ-2D,苏州净化设备
方法
1 动物分组与植入方法
将9只新西兰兔分为3组,即供试品-1组(6.25 mg/kg)、供试品-2组(12.5 mg/kg)和供试品-3组(25 mg/kg),每组3只,各组采用自身空白对照,通过皮下注射在动物背部植入吸收性止血生物材料,每个时间点1只动物(3个时间点:植入后第3天、第7天和第14天),每侧4个皮下囊,左侧背部皮下给供试品-1、供试品-2或供试品-3,右侧背部皮下给0.9%氯化钠注射液,植入体积为0.5 mL/个皮下囊。
2 检测指标与频率
植入供试品后,每天观察各组新西兰兔的精神状态、活动、饮食,触诊皮下囊部位包块的大小、活动程度、质地软硬,并做相关的观察记录。根据观察记录分析供试品于每个时间点在皮下组织残留的程度,具体量化公式如下:
残留程度(%)=残留供试品的皮下囊个数/4×100%
在第3天和第7天用20%乌来糖腹腔注射麻醉后颈动脉放血处死动物,剥取背部皮下囊部位皮肤组织,观察并拍照。然后取皮下囊部位组织经12%甲醛溶液固定,常规石蜡包埋,HE染色,光镜检查。
结果
1 大体观察结果
每日大体观察发现,植入后第3、7、14天各组新西兰兔的精神状态、活动、饮食均正常,肉眼未见皮下囊突起;触诊皮下囊部位包块的大小、活动程度、质地软硬,结果发现皮下囊部位不存在任何包块。统计如下表:
表1. 吸收性止血生物材料在新西兰兔皮下的残留程度
组别时间点残留程度
空白对照第3天0/12(0%)
第7天0/12(0%)
第14天0/12(0%)
供试品-1(6.25 mg/mL)第3天0/4(0%)
第7天0/4(0%)
第14天0/4(0%)
供试品-2(12.5 mg/mL)第3天0/4(0%)
第7天0/4(0%)
第14天0/4(0%)
供试品-3(25 mg/mL)第3天0/4(0%)
第7天0/4(0%)
第14天0/4(0%)
2 解剖时观察结果
沿脊椎将新西兰兔背部两侧皮肤剪开,与肌肉分离。除了第3天的高剂量组的4号取材点,第3天和第7天各组肉眼均未见皮下囊包块的存在,且未发现其他异常情况。
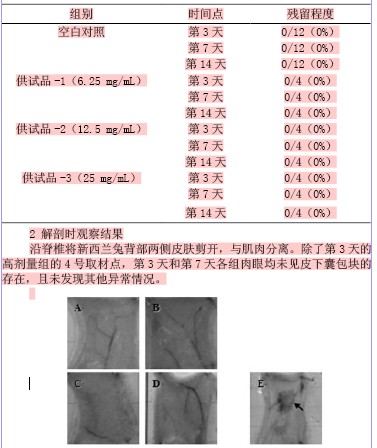
图1. 吸收性止血生物材料植入后第3天的新西兰兔背部皮肤组织解剖照片
A-D分别为空白对照、供试品-1、供试品-2、供试品-3这4组皮下囊部位组织的代表性照片,E为供试品-3组的4号取材点照片,箭头所指为皮下囊包块。
3 镜检结果
植入后第3、7、14天的镜检结果发现(见图2),空白对照组皮肤表皮及真皮均无明显的病理改变,皮肤附件结构正常,皮下及周围组织也未见充血、水肿及炎细胞浸润;供试品各组皮肤表皮及真皮均无明显的病理改变,皮肤附件结构正常。与解剖时肉眼观察结果一致,供试品-3组在植入后第3天的4号取材点皮下可见极少量未吸收的卵圆形颗粒,虽然在植入后第7天解剖时肉眼未曾观察到皮下囊包块,但镜检仍可发现4号取材点皮下有极少量未吸收的卵圆形颗粒,而植入后第14天各取材点不见任何未吸收的颗粒;供试品-1和供试品-2组在各个时间点的各个取材点均未见未吸收的颗粒。
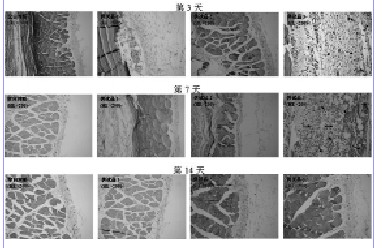
图2. 吸收性止血生物材料植入后新西兰兔背部皮下及周围组织镜检图片(HE×200)
供试品-1、供试品-2、供试品-3的浓度分别为6.25 mg/mL、12.5 mg/mL、25 mg/mL吸收性止血生物材料。箭头所指处即为未吸收的供试品。
讨论
从大体观察来看,吸收性止血生物材料在第3、7、14天均未出现任何皮下残留,百分百被吸收;进一步解剖肉眼观察则发现,除了25 mg/mL在第3天有皮下残留,其余各个时间点各个浓度均未出现皮下残留;HE染色镜检结果与肉眼观察结果一致,仅发现第3天和第7天的25 mg/mL组的4号取材点有极少量未被吸收的供试品。可见,该吸收性止血生物材料在新西兰兔皮下的吸收过程是循序渐进的,基本在第14天被完全吸收。刘成程等[3]将0.2 g玉米多孔淀粉植入小鼠右股,2天后多孔淀粉基本被完全吸收,植入组织周围有少量炎性细胞浸润,6天后完全被吸收,炎症反应消除。而在本实验的无菌操作下,该吸收性止血生物材料未引起新西兰兔被植入部位的任何炎症反应。
结论
6.25 mg/mL、12.5 mg/mL和25 mg/mL的吸收性止血材料在新西兰兔背部皮下很快被吸收,一周内基本没有吸收性止血材料的残留,在机体内两周便可完全吸收,对于手术应用安全性颇佳。
参考文献
[1]张少峰,洪加源.医用生物可吸收止血材料的研究现状与临床应用.中国组织工程研究.2012,16(21):3941-3944.
[2]牛雯,刘毅,刘曼玲等.一种可吸收多聚糖止血材料的生物降解研究.中国新药杂志.2010,19(4):336-339.
[3]刘成程.高吸水性玉米多孔淀粉的制备及其生物相容性和止血效果的研究.陕西:西北大学,2010.
论文作者:徐国丽1,林娜2,薛乐珍2(通讯作者)
论文发表刊物:《医药前沿》2013年11月第32期供稿
论文发表时间:2014-1-3
标签:皮下论文; 新西兰论文; 生物论文; 材料论文; 吸收性论文; 背部论文; 批号论文; 《医药前沿》2013年11月第32期供稿论文;
